I veterinari hanno a disposizione un’ampia gamma di metodi di rilevamento diversi per la diagnosi delle malattie infettive. Tuttavia, la scelta del test “giusto” per il caso in questione può essere scoraggiante. Che cosa ha un valore clinico più elevato: il rilevamento degli anticorpi o quello diretto dei patogeni? Qual è la differenza concreta e a quale stadio dell’infezione ciascun metodo è più adatto? Questo approfondimento presenterà le basi di ciascuno strumento diagnostico e spiegherà quando è meglio scegliere un metodo piuttosto che un altro.
Ci sono 3 ragioni principali per cui i test diagnostici per le malattie infettive vengono eseguiti nella pratica veterinaria:
- verifica della presenza di agenti infettivi nelle fasi acute e croniche della malattia
- rilevazione della diffusione di agenti patogeni nelle infezioni subcliniche (per ridurre al minimo il potenziale di trasmissione ad altri animali)
- conferma che un animale è esente da infezioni (ad esempio negli animali da riproduzione e per l’importazione/esportazione)
I metodi di rilevamento diretto dei patogeni identificheranno gli stessi patogeni causativi (o almeno parti del loro genoma o antigeni prodotti). Il rilevamento degli anticorpi è un metodo diagnostico indiretto, che rivelerà un contatto precedente, dimostrando una reazione immunitaria contro un agente patogeno specifico. Sono disponibili diversi test di laboratorio, che utilizzano diverse metodiche per rilevare anticorpi e/o agenti infettivi (Tab.1).
-
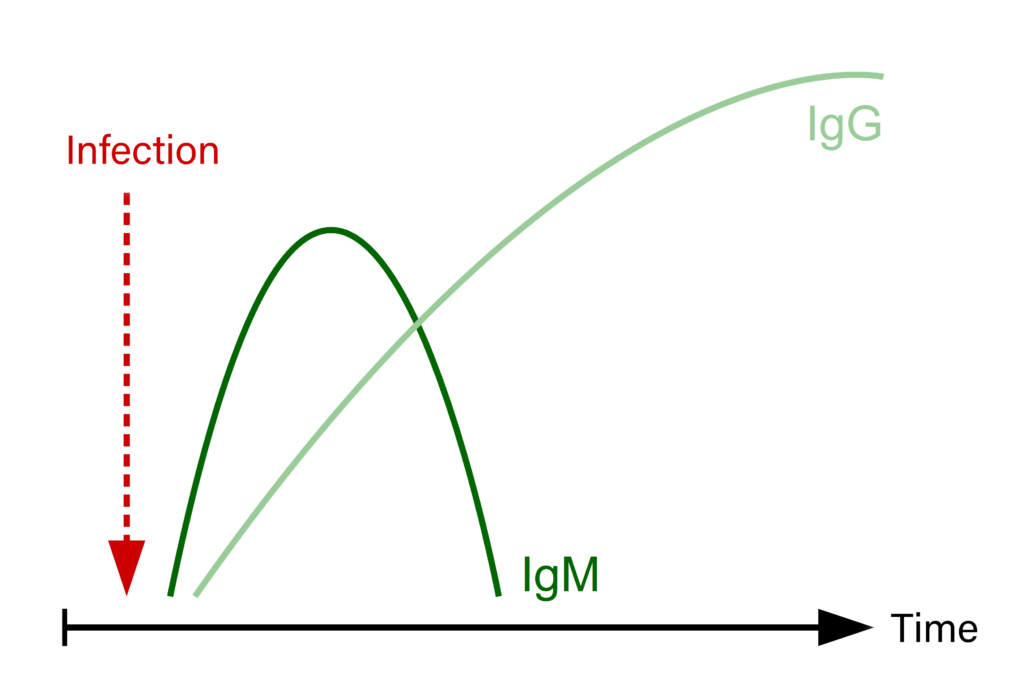
Fig. 1: Sviluppo dei titoli IgM e IgG in seguito ad un’infezione
Immagine: Laboklin
-
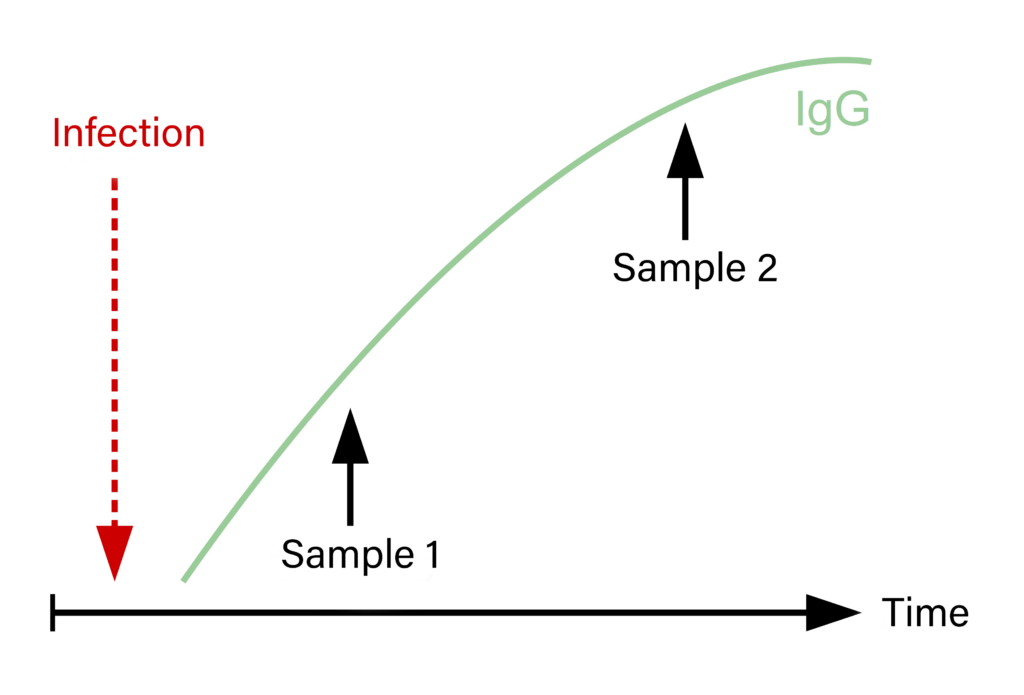
Fig. 2: Coppie di sieri e aumento del titolo dopo una recente infezione
Immagine: Laboklin
Tab. 1: Metodi diagnostici per il rilevamento di infezioni malattie e loro utilizzo; Fonte: Laboklin
| Metodica | Rilevamento diretto del patogeno | Rilevamento degli anticorpi |
| Microscopia/microscopia elettronica | X | |
| Coltura microbiologica | X | |
| Immunoistochimica | X | |
| PCR (Polymerase-Chain-Reaction) | X | |
| ELISA (Enzyme Linked Immunosorbent Assay) | X | X |
| IFT (Immunofluorescenza) | X | X |
| VNT (test di virus neutralizzazione) | X | |
| Western Blot (WB) | X | |
| LFT (Lateral Flow tests) | X | X |
| e altre |
Metodiche diverse possono portare a risultati diversi e vi è una grande varietà e discrepanza nella sensibilità e specificità del singolo test. È importante tenere presente che nessun test potrà mai fornire una sensibilità e una specificità pari al 100%. In molti casi, una combinazione di diversi metodi diagnostici sarà la scelta più utile e significativa.
Rilevazione diretta dei patogeni
Esistono diverse metodiche per la rilevazione diretta degli agenti patogeni. Alcuni esempi: la microscopia, snap-test, immunofluorescenza (IFT) e i test immunoenzimatici (EIA), che possono rilevare gli antigeni patogeni. Inoltre, esiste anche la reazione a catena della polimerasi (PCR, rilevamento di sequenze genomiche specifiche del patogeno) e la coltura microbiologica. Per tutti questi strumenti diagnostici esiste una distinzione tra metodiche dirette e indirette.
La scelta del materiale da raccogliere è di fondamentale importanza e dipende da dove si prevede la presenza dell’agente patogeno al momento del campionamento. A seconda dell’agente infettivo e del metodo di analisi, possono essere validi materiali diversi: sangue, tamponi, feci, urina, aspirato, tessuti, raschiati cutanei, pelo e così via. Quale di questi campioni può essere utilizzato dipende da vari fattori. La conoscenza della patogenesi delle specifiche malattie infettive, in particolare degli organi bersaglio e della via di diffusione, è fondamentale. Inoltre, è importante conoscere lo stadio dell’infezione al momento del campionamento, nonché l’età e lo stato immunitario (e vaccinale) del paziente.
Preanalitica
Prima di testare un campione, è importante sapere se gli agenti infettivi devono essere vivi e in grado di replicarsi o meno. A seconda di ciò, potrebbe essere necessario testare tempestiva-mente il campione o l’uso di terreni di trasporto speciali, il che è particolarmente importante per le colture microbiologiche. È importante seguire le istruzioni specifiche per il particolare campione fornite dal laboratorio prescelto per ricevere i risultati del test più significativi possibili. Ad esempio, per i test PCR, noi consigliamo di inviare tamponi asciutti senza mezzi di trasporto, sangue intero EDTA, fluidi in provette sterili e non rivestite nonché tessuto nativo non fissato.
Nella situazione ottimale, il campionamento dovrebbe essere effettuato il più presto possibile nel corso dell’infezione e sempre prima dell’inizio di qualsiasi terapia.
Mentre qualsiasi risultato negativo del test non può mai escludere un’infezione con assoluta certezza, un risultato positivo del test solitamente conferma la presenza di un agente infettivo. Tuttavia, un risultato positivo non sempre presenta una correlazione tra agente patogeno e malattia clinica. Particolare attenzione deve essere prestata all’interpretazione dei risultati di metodiche particolarmente sensibili. La capacità di replicarsi e quindi l’infettività di alcuni agenti patogeni, può essere confermata solo in colture microbiologiche.
Rilevazione degli anticorpi
Gli anticorpi sierici possono avere origini diverse:
- anticorpi materni: possono essere presenti nei puledri fino a 6-8 settimane (raramente fino a 6 mesi). Questo deve essere preso in considerazione quando ci troviamo ad interpretare risultati positivi in questa fascia di età.
- vaccinazione: in generale non è possibile una differenziazione diretta tra gli anticorpi post vaccinazione e post infezione (fanno eccezione i cosiddetti vaccini marcatori).
- infezione: i titoli anticorpali persistono per lungo tempo dopo l’infezione.
È necessario un certo lasso di tempo affinché il sistema immunitario sviluppi anticorpi specifici dopo il contatto con un agente patogeno (vaccinazione o infezione). Il primo sottogruppo di immunoglobuline a comparire sono gli anticorpi IgM, che possono essere rilevati dopo circa 1-2 settimane, a seconda dell’agente infettivo e dello stato immunitario dell’ospite. Gli anticorpi IgG possono essere rilevati dopo circa 3 settimane e nella maggior parte dei casi persistono per un lungo periodo di tempo (Fig.1). Per le infezioni causate da determinati agenti patogeni, questi periodi di tempo possono variare e alcuni agenti infettivi, ad esempio i micoplasmi, non innescano la formazione di anticorpi.
Pertanto è possibile aspettarsi un titolo anticorpale positivo solo dopo un certo periodo di tempo. Negli stadi acuti e iperacuti della malattia non è possibile rilevare anticorpi e, soprattutto in caso di infezioni virali, è possibile solo una diagnosi retrospettiva.
Per alcuni agenti patogeni (ad es. West Nile, TBE e Borrelia) è possibile il rilevamento simultaneo di anticorpi IgM e IgG. Poiché entrambi sono presenti a diversi stadi dell’infezione, il rilevamento contemporaneo di entrambi aiuterà a determinare se a è presente un’infezione recente (IgM ↑) o se l’infezione persiste da più tempo (IgG ↑).
Tuttavia, per la maggior parte degli agenti patogeni sono disponibili solo test per la determinazione delle IgG. Un singolo test su un singolo campione non fornirà un risultato significativo. Ad esempio, un risultato positivo potrebbe indicare un’infezione precedente o una vaccinazione. Se il campione è stato prelevato troppo presto, sono possibili risultati falsi negativi.
Al contrario, un confronto di una coppia di sieri, effettuata a circa 2-4 settimane di distanza, aiuterà nella diagnosi e faciliterà l’interpretazione dei risultati del test, sebbene in alcuni casi ciò sarà possibile solo retrospettivamente. Un aumento di 4 volte del titolo anticorpale, o un aumento comparativo significativo di un valore di rilevazione, indicherà un’esposizione recente (vaccinazione o infezione acuta; Fig. 2).
Nei casi in cui i risultati non sono chiari, o se si effettua solo una rilevazione diretta dell’agente patogeno, sarebbe consigliabile prelevare un campione di siero all’inizio della malattia.
Questo campione di siero può poi essere congelato a – 20°C e può essere esaminato come campione “acuto” insieme ad un campione di “convalescenza” prelevato in un secondo momento, per completare la coppia di siero.
Laboratori diversi utilizzeranno valori di riferimento diversi così come diverse saranno le procedure e le attrezzature tecniche, quindi, i risultati di questi laboratori non saranno direttamente confrontabili. Pertanto, i campioni delle coppie di siero dovranno essere analizzati dallo stesso laboratorio e con la medesima metodica.
Per rilevare gli anticorpi nel siero, i metodi più comunemente utilizzati sono i test di immunoassorbimento enzimatico o i test di immunofluorescenza. Sono disponibili anche test rapidi, solitamente sotto forma di dispositivi a flusso laterale. Per richieste più specifiche, per alcuni agenti patogeni è disponibile anche il Western Blot, che può essere utilizzato per confermare i risultati di altri test. Il metodo diagnostico sierologico più specifico è il test di neutralizzazione del virus, che determina un effetto citopatico nelle colture cellulari.
Rileva gli anticorpi che neutralizzano i virus e quindi inibisce l’infettività di questi virus. Pertanto, questo test fornirà anche un’indicazione sulla presenza di anticorpi protettivi in vivo. Al contrario, la rilevazione degli anticorpi mediante ELISA non è un’indicazione affidabile della presenza di anticorpi protettivi. A seconda dell’agente patogeno, la risposta immunitaria cellulare potrebbe essere di pari o maggiore importanza della risposta immunitaria umorale.
Per i test sierologici, i campioni più appropriati sono il siero e il plasma. Questi dovrebbero essere processati il prima possibile dopo il prelievo di sangue, per evitare l’emolisi che può interferire con i test. In alcuni casi, gli anticorpi possono essere rilevati anche in altri liquidi, come il liquido cerebrospinale o l’umor acqueo. Poiché gli anticorpi sono relativamente stabili nei campioni, l’elaborazione in laboratorio non è urgente. Pertanto, il siero può essere conservato per un periodo di tempo più lungo, refrigerato o congelato a -20°C.
La presenza di un titolo anticorpale positivo contro uno specifico patogeno non fornisce la prova conclusiva che detto patogeno sia effettivamente l’agente eziologico di una malattia. Per l’interpretazione di questi risultati è necessario prendere in considerazione il quadro complessivo, compresi i sintomi clinici e, se disponibili, i dati epidemiologici.
I test sierologici possono offrire vantaggi rispetto alla rilevazione diretta degli agenti patogeni, in particolare se gli agenti patogeni in questione sono presenti nel sangue periferico solo stagionalmente o periodicamente oppure se sono presenti solo a livello tissutale.
Conclusioni
A causa della grande varietà di agenti infettivi, non è possibile offrire una raccomandazione generica su quale test diagnostico scegliere. Sia il rilevamento diretto del patogeno che quello degli anticorpi sono validi e sono di comune uso clinico. A seconda del problema, possono essere utilizzati insieme e completarsi a vicenda (Tab. 2). In molti casi è utile e necessario eseguire diverse metodiche.
Prima di inviare i campioni per i test ai laboratori, i veterinari devono raccogliere un’anamnesi sufficiente, eseguire un esame clinico e formulare una diagnosi preliminare, determinando anche il probabile stadio dell’infezione. Alla fine, con la patogenesi del rispettivo agente infettivo e con le metodiche disponibili si deciderà quale test diagnostico è meglio eseguire. Per ottenere risultati più significativi, sono importanti i seguenti punti:
- tempistica del campionamento
- tipo, qualità e quantità del campione
- stabilizzatori o mezzi di trasporto se necessari
- tempistiche e condizioni di trasporto
Dott.ssa Michaela Gentil
Puoi trovare la nostra ampia offerta di servizi relativi alla diagnostica diretta e indiretta dei patogeni nei cavalli nella sezione “Malattie infettive” su: www.laboklin.com
Tab. 2: Breve e diretto: alcuni esempi di agenti infettivi e possibili metodi di rilevamento (grassetto = metodo scelto); Immagine: Laboklin
| Patogeno | Rilevamento diretto del patogeno | Rilevamento degli anticorpi |
| Herpesvirus equino 1 | PCR su sangue EDTA (solo durante la fase febbrile!), tampone nasale profondo, feti morti e placenta, liquido cerebrospinale, tutto a seconda dei sintomi clinici | Malattia da iperacuta ad acuta, elevata sieroprevalenza nella popolazione equina a causa dell’ampia distribuzione del virus e della vaccinazione: è possibile il rilevamento retrospettivo tramite coppia di sieri |
| Borrelia burgdorferi | Il rilevamento diretto è difficile: se necessario, è possibile la PCR dalla sinovia o da biopsie cutanee o articolari | Anticorpi IgM e IgG come test di screening, Western Blot per conferma e utile per differenziare gli anticorpi di vaccinazione/infezione |
| Virus West Nile | La PCR su sangue EDTA spesso ha un valore clinico basso, poiché la viremia si attenua nel momento in cui compaiono i sintomi clinici; è possibile tentare il rilevamento del virus mediante PCR nel liquido cerebrospinale o nei tessuti (post mortem) | Rilevazione simultanea die anticorpi IgM e IgG mediante ELISA; sono possibili reazioni crociate con altri flavivirus (ad es. TBE, Usutu)! Nei casi positivi, la differenziazione viene effettuata utilizzando la VNT |
| Dermatophilus congolensis | Rilevamento in forfora e croste, mediante citologia (sensibilità limitata) o PCR | Nessun test disponibile |
| Anaemia infettiva equina (EIA) | Elevata variabilità genetica del virus, rilevamento difficile | Una volta infettati, gli animali rimangono portatori del virus per tutta la vita (infezione persistente) e sieropositivi; diagnosi tramite test di Coggins o c-ELISA. Tuttavia: il periodo di incubazione dura fino a 3 mesi, durante questo periodo i test dovranno essere ripetuti! Importante: i puledri di cavalle infette possono essere positivi fino a 6 mesi a causa degli anticorpi materni. |