Essendo l’organo più grande del corpo, la cute è facilmente accessibile per gli esami diagnostici, ma l’esame dei pazienti dermatologici risulta spesso difficoltoso. Per questo motivo, anche i pazienti con patologie della cute che a prima vista sembrano prive di complicazioni, vengono sempre visitati secondo un piano diagnostico sistematico, in modo da non trascurare alcuna diagnosi differenziale.
Dopo un’anamnesi dettagliata e un esame clinico-dermatologico, si procede con una valutazione più approfondita delle alterazioni individuate durante la visita dermatologica. La citologia è uno dei metodi più importanti in questo caso perché non solo fornisce informazioni essenziali per la diagnosi, ma è anche fondamentale per la gestione terapeutica.
Ogni alterazione cutanea deve essere valutata citologicamente al momento della presentazione iniziale, per pianificare, se necessario, ulteriori passaggi diagnostici e indirizzare il trattamento nella giusta direzione fin dall’inizio.
Campionamento
La scelta della tecnica di campionamento dipende sempre dal tipo di lesioni cutanee. In generale, i campioni per impronta sono i migliori per la valutazione, ma forniscono materiale sufficiente solo in caso di lesioni essudanti o superfici cutanee sebacee/oleose.
Nei pazienti alopecici o con ipotricosi, con superficie cutanea intatta, si ricorre pertanto allo “Scotch® test” . Nei punti difficili da raggiungere si può utilizzare un nastro adesivo trasparente per prelevare il materiale da inviare (ad esempio tra le dita) oppure effettuare dei tamponi (classicamente nel condotto uditivo, ma anche nelle fistole, nel letto auricolare o interdigitale).
In ogni caso è importante che il materiale venga prelevato correttamente per ottenere campioni significativi e ben valutabili. Si raccomanda inoltre di etichettare i vetrini prima del prelievo del campione (nome del paziente, sede, tecnica di campionamento).
Tecnica per impronta
Si preme il vetrino sulla zona interessata della cute e poi si lascia asciugare all’aria. Quando si esegue uno striscio, bisogna fare attenzione a non strofinare le lesioni cutanee con il vetrino, poiché ciò distruggerebbe le cellule e al microscopio rimarrebbero visibili solo i resti nucleari e i filamenti di cromatina. Soprattutto nel caso di lesioni molto essudanti, è meglio preparare i campioni dopo aver asciugato / tamponato la lesione da esaminare con un panno privo di lanugine. Se sono presenti croste più grandi, è opportuno esaminare anche la loro parte inferiore, poiché è qui che spesso si possono ottenere molte cellule e dove anche i microrganismi possono essere rilevati particolarmente bene.
Ago infissione
Le lesioni piene di liquido, come le pustole, vengono perforate mediante un ago. Se è disponibile liquido a sufficienza, è meglio aspirarlo con una siringa, come in un’aspirazione con ago sottile, e distribuirlo sul vetrino, altrimenti il contenuto della pustola da esaminare fuoriesce dopo la puntura. Posizionando un vetrino da microscopio su queste gocce, si ottiene un’ottima preparazione citologica per la valutazione del contenuto della pustola.
Impronta con nastro adesivo
Il metodo del nastro adesivo può essere utilizzato in punti difficili da raggiungere (ad esempio tra le dita) o quando la pelle è così secca che nessun materiale si attacca al vetrino.
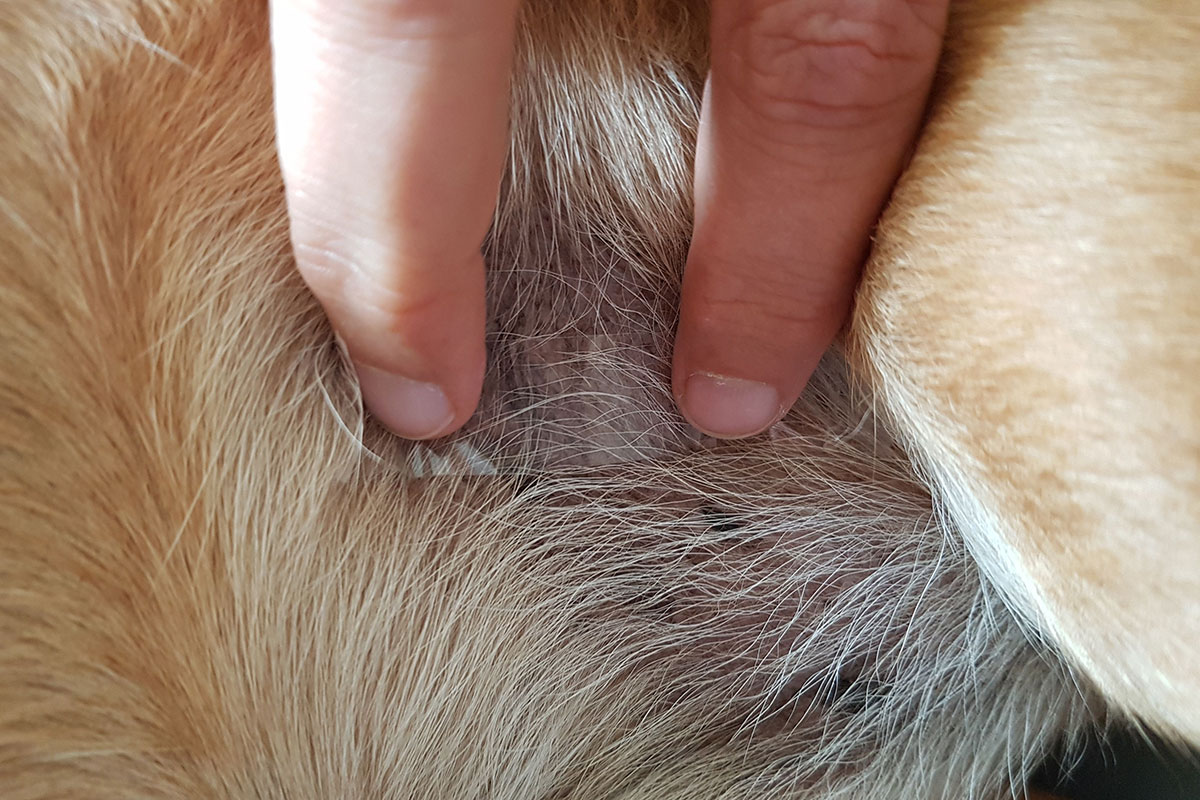
La striscia adesiva trasparente viene premuta più volte sulla zona cutanea interessata, fino a quando non aderisce una quantità sufficiente di materiale e la striscia non si attacca più (Fig. 2).
Preparazione dello striscio
Per preparare gli strisci con tampone o citospazzola, il tampone o la citospazzola vengono prima fatti rotolare sul tessuto da esaminare o inseriti con attenzione nel condotto uditivo o in una fistola con un leggero movimento di torsione.
Il materiale viene poi fatto rotolare delicatamente sul vetrino. Come per l’impronta, è importante non strofinare le lesioni con il tampone per proteggere le cellule!
Raschiati cutanei
I raschiati cutanei non sono adatti all’esame citologico perché solitamente le cellule vengono distrutte dal raschiamento. Tuttavia, il materiale sebaceo / grasso può anche essere raccolto con un bisturi, come se si stesse raschiando la pelle in modo superficiale, e distribuito su un vetrino da microscopio.
-
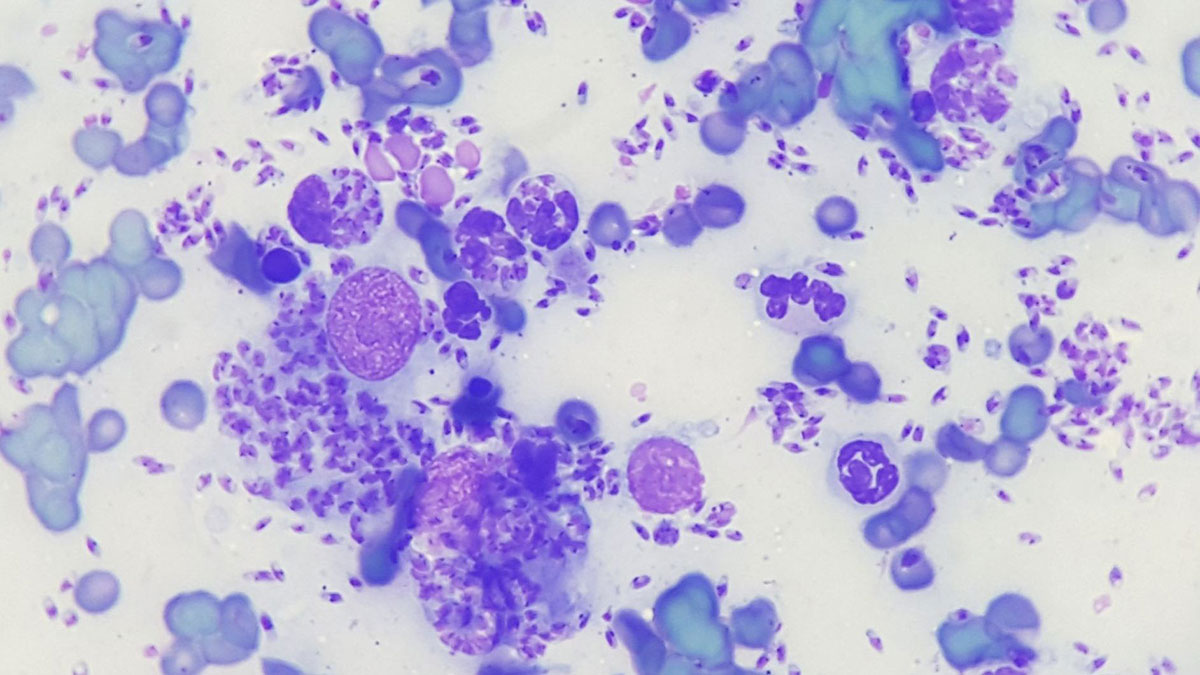
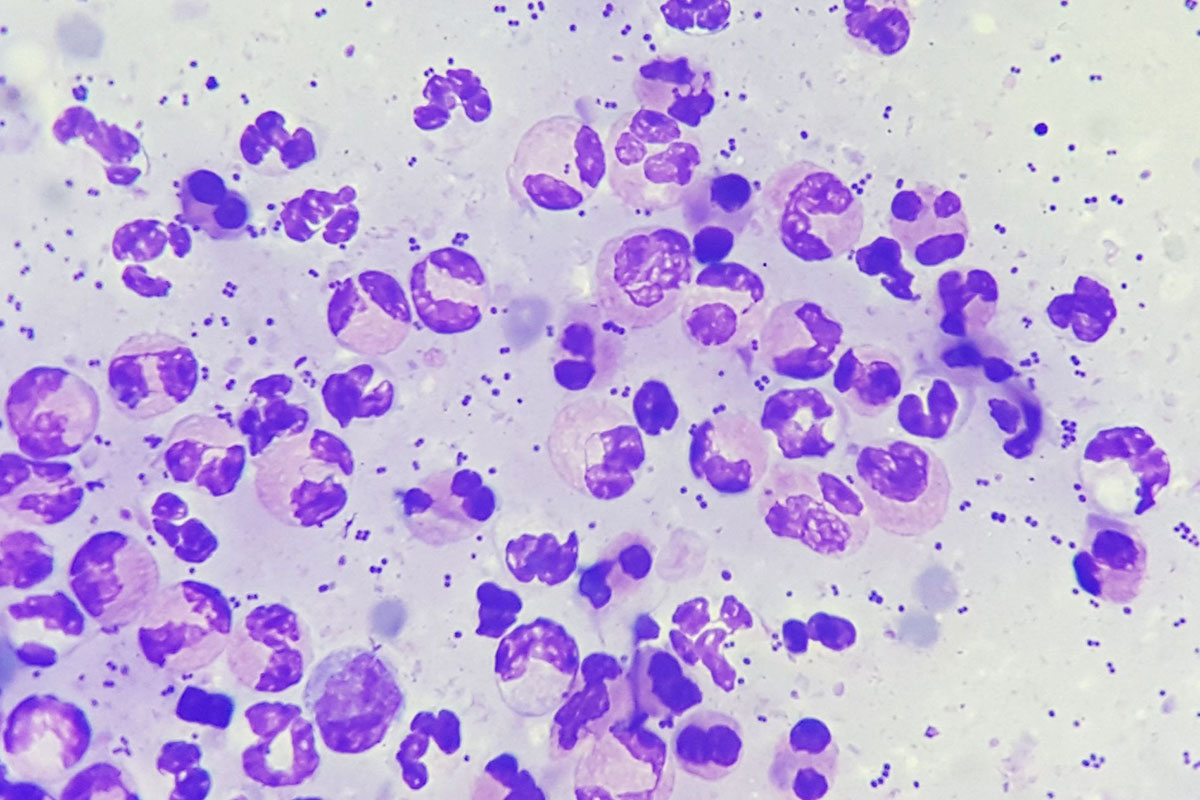
Fig. 1: Infiammazione piogranulomatosa con evidenza di Leishmania
Immagine: Dr. Maria Christian
-
Fig. 2: Impronta con nastro adesivo
Immagine: Dott. Maria Cristiana
-
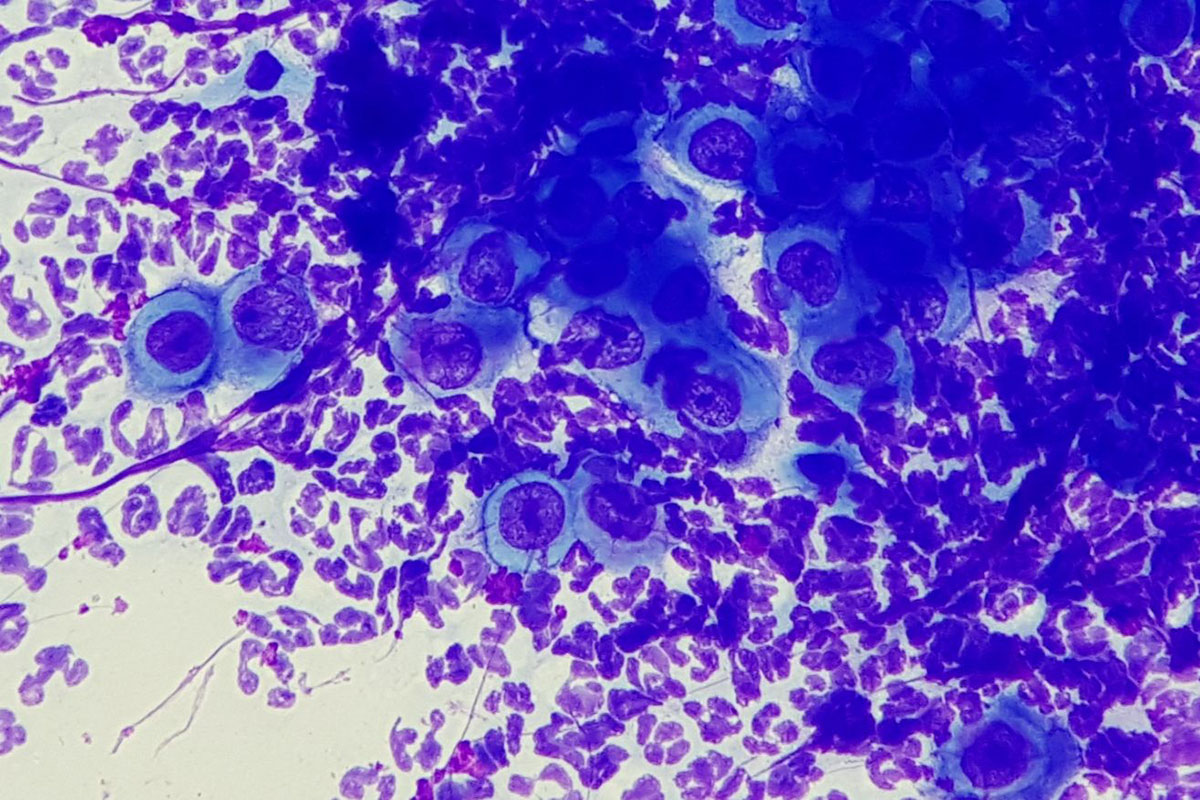
Fig. 3: Colorazione del campione con nastro adesivo
Immagine: Dott. Maria Cristiana
-
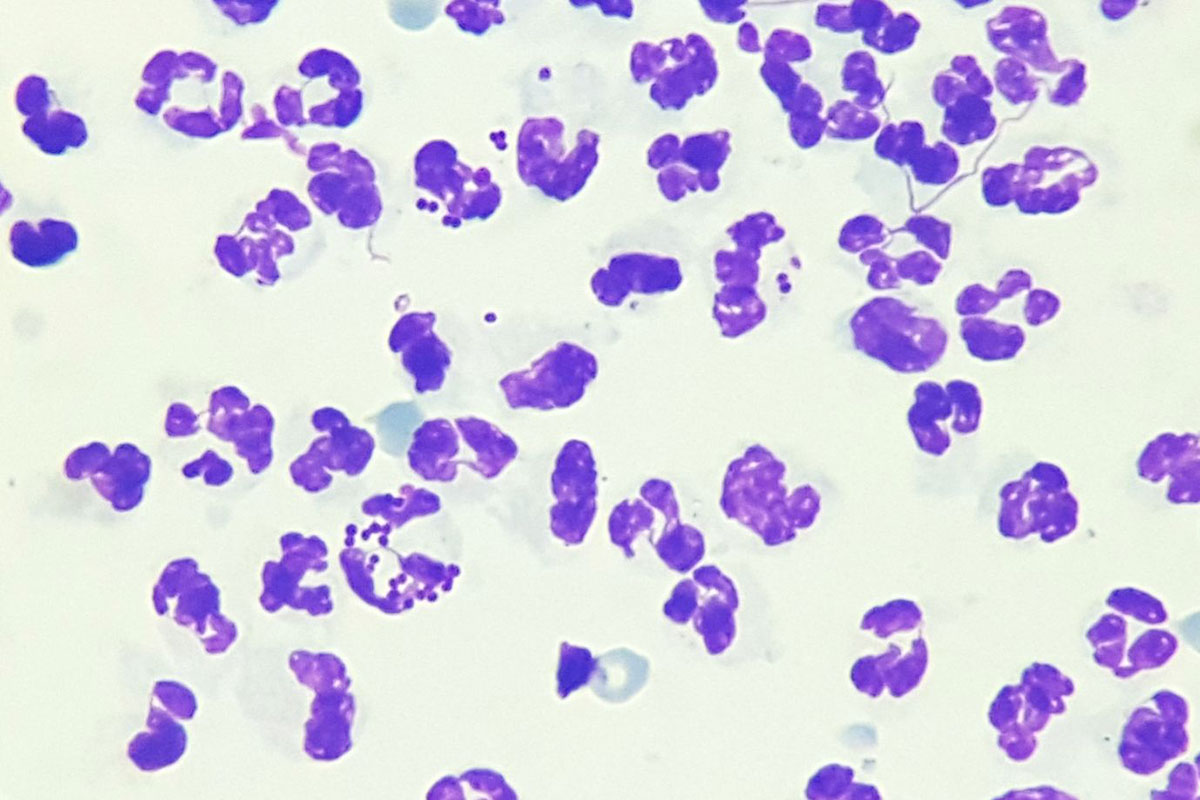
Fig. 4: Piodermite in un cane
Immagine: dott.ssa Maria Christian
-
Fig. 5: Pemfigo foliaceo gatto
Immagine: dott.ssa Maria Christian
-
Fig. 6: Placca eosinofilica, infezione secondaria gatto
Immagine: dott.ssa Maria Christian
-
Fig. 7: Linfoma cutaneo cane
Immagine: dott.ssa Maria Christian
Colorazione dei preparati
Una volta che il materiale sul vetrino si è completamente asciugato, il campione può essere colorato. Le colorazioni tipo Romanovsky disponibili in commercio (ad esempio Diff-Quik®) sono molto adatte all’uso pratico. In linea di principio si devono rispet- tare i tempi di colorazione indicati dal produttore, ma in alcuni casi è necessario prolungare i tempi di immersione:
ad esempio, i preparati citologici, che spesso sono più spessi degli strisci di sangue, impiegano più tempo per assorbire abbastanza colore. Se il colore è stato utilizzato per diverse settimane, probabilmente si noterà. Per esempio, la soluzione blu è la prima a produrre risultati di colorazione più scadenti, come si può osservare su preparati chiari. Questo inconveniente può essere temporaneamente risolto immergendo i campioni più frequentemente o per periodi più lunghi, ottenendo comunque un risultato di colorazione accettabile. Tuttavia, se le cellule appaiono ancora pallide al microscopio anche dopo tempi di colorazione prolungati o se sono contaminate da batteri, le soluzioni coloranti devono essere sostituite. In contenitori ermeticamente chiusi (ad esempio contenitori per l’urina, scatole per congelatore ermeticamente chiuse o barattoli di marmellata), i reagenti possono essere conservati per un periodo di tempo più lungo rispetto alle classiche vasche di colorazione. Dopo aver risciacquato i residui di colore con acqua di rubinetto, i campioni vengono nuovamente asciugati all’aria. In casi urgenti, questa operazione può essere eseguita anche in un’incubatrice oppure il processo può essere accelerato utilizzando un phon o posizionando il campione su una superficie calda (ad esempio su un’apparecchiatura di laboratorio in funzione).
Le preparazioni adesive non necessitano di asciugatura e non è necessario alcun fissaggio, poiché il campione è già fissato dall’adesivo e, inoltre, la soluzione di fissaggio alcolica intorbidisce molte strisce adesive. Per la colorazione, la striscia adesiva viene attaccata a un’estremità di un vetrino e immersa nelle soluzioni coloranti, utilizzando il vetrino come impugnatura (Fig. 3). Dopo l’asciugatura, la striscia adesiva viene prima rimossa e poi attaccata al vetrino con il lato del campione rivolto verso il basso, sopra una goccia d’olio.
Valutazione microscopica
La valutazione citologica della superficie cutanea viene effettuata soprattutto in relazione al tipo di infiammazione o di infezioni secondarie presenti, ma in alcuni casi la citologia superficiale può evidenziare anche una neoplasia.
Se la maggior parte delle cellule sono granulociti neutrofili, è presente un’infiammazione neutrofila o purulenta. Classicamente, queste infiammazioni indicano un processo infettivo (soprattutto batterico, Fig. 4), ma possono anche essere sterili (ad esempio malattie immunomediate come il pemfigo foliaceo, Fig. 5, o infiammazione concomitante di neoplasie). In caso di infezioni batteriche, i neutrofili mostrano spesso alterazioni degenerative. I nuclei sono gonfi e di colore pallido; in casi estremi è difficile riconoscere le cellule come neutrofili. Nella maggior parte dei casi è possibile rilevare anche la presenza di batteri intracellulari che, a differenza dei batteri extracellulari, sono la prova della presenza di un evento settico. Anche funghi e protozoi possono causare infiammazioni purulente.
Se oltre ai neutrofili sono presenti fino al 50% di macrofagi, si ha un’infiammazione piogranulomatosa; se sono presenti più del 50% di macrofagi, l’infiammazione è detta granulomatosa. Le stesse cause sono responsabili dello sviluppo di questi due tipi di infiammazione, la maggior parte dei quali sono processi cronici. Le reazioni tipiche sono a corpi estranei, micosi, infezioni da protozoi (ad esempio Leishmania, Fig. 1) e alcuni batteri (ad esempio micobatteri, attinomiceti).
L’infiammazione eosinofila è caratterizzata da una percentuale di granulociti eosinofili superiore al 10% tra le altre cellule infiammatorie. Se i batteri intracellulari sono rilevabili nelle infiammazioni eosinofile, queste rappresentano solitamente un’infezione secondaria. Le cause primarie di queste infiammazioni sono le malattie del complesso del granuloma eosinofilo (Fig. 6), le neoplasie (in particolare i tumori dei mastociti e i linfomi), le allergie e i parassiti. Tra gli eosinofili si trovano spesso mastociti e talvolta granulociti basofili, in quantità variabili. Se il numero dei mastociti è molto elevato, nella diagnosi differenziale si deve prendere in considerazione un tumore dei mastociti. Le infiammazioni linfocitarie, plasmacellulari e linfoplasmocellulari (oltre il 50% linfociti/plasmacellule) si verificano solitamente nel corso di processi cronici, in eventi immunomediati, in infezioni virali e anche in reazioni di ipersensibilità. Se il contenuto di plasmacellule è molto elevato, nella diagnosi differenziale si deve prendere in considerazione un tumore delle plasmacellule. Se si riscontra un numero aumentato di linfociti di medie dimensioni, di blasti linfoidi o di una popolazione monomorfica di linfociti, è necessario chiarire la presenza di un linfoma (Fig. 7).
Poiché molti pazienti affetti da patologie dermatologiche soffrono di malattie croniche, la citologia non viene utilizzata solo a fini diagnostici, ma spesso anche a fini di monitoraggio e viene eseguita a ogni controllo. Per questo motivo è importante documentare i risultati, incluso il numero di batteri, Malassezia e cellule infiammatorie riscontrate, per determinare chiaramente eventuali miglioramenti o peggioramenti dell’infiammazione e dell’infezione secondaria. Soprattutto all’inizio, i microrganismi e le cellule sono così numerosi che è quasi impossibile contarne le strutture. Tuttavia, sono sufficienti informazioni semiquantitative, ad esempio come 1+, 2+ e 3+. 1+ significa che sono presenti solo pochi batteri/Malassezia/cellule infiammatorie, che possono essere individuati solo dopo un’attenta ricerca e possibilmente solo in pochi punti. Un risultato pari a 2+ indica che sono presenti pochi batteri / Malassezia / cellule infiammatorie, ma sono visibili immediatamente. Se sono presenti abbondanti batteri/Malassezia/cellule infiammatorie, il valore è riportato come 3+.
Conclusioni
La citologia dermatologica è una tecnica di esame rapida e conveniente che fornisce informazioni diagnostiche essenziali ed è inoltre fondamentale per la scelta della terapia. Con un po’ di pratica, è possibile eseguirla in modo affidabile in ambulatorio, garantendo così una cura ottimale della cute del paziente fin dalla prima visita. Si consiglia di consultare la letteratura specialistica (vedere qui sotto) e, se non si ha ancora esperienza in citologia, di partecipare a workshop in cui vengono consolidate le basi della diagnostica citologica e citologi esperti possono rispondere anche a domande tecniche complesse (ad esempio presso la Laboklin Academy all’indirizzo https://laboklin.de/de/).
Dott.ssa Maria Christian
Esami pertinenti disponibili presso Laboklin
Citologia
Istologia
Esame batteriologico e micologico
Rilevamento del patogeno tramite PCR