Negli ultimi anni hanno acquisito sempre maggiore importanza gli ausili diagnostici e terapeutici non invasivi, è questo il motivo per cui i biomarker stanno acquisendo sempre maggiore importanza nel processo diagnostico anche in medicina veterinaria. I biomarker sono composti misurabili che possono essere utilizzati come indicatori per vari processi fisiologici o patologici e quindi hanno un sicuro significato prognostico e diagnostico. In alcuni casi possono fornire delle importanti informazioni aggiuntive per un esame clinico completo e possono quindi contribuire a prendere le corrette decisioni mediche. I biomarker molecolari possono essere misurati in campioni biologici (come siero, plasma o liquido cerebrospinale) e si tratta di molecole specifiche, enzimi od ormoni.
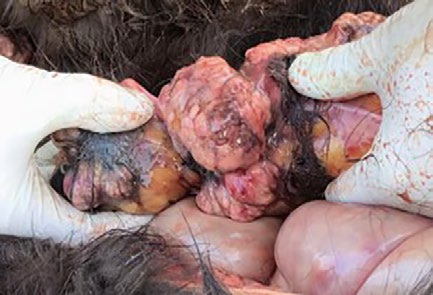
I biomarker vengono utilizzati specialmente nella diagnostica dei tumori come strumenti utili e non invasivi per la diagnosi, la prognosi ed il monitoraggio della terapia. Nella medicina equina, la diagnostica neoplastica sta diventando sempre più importante a causa dell’aumento dell’età media della popolazione equina ed è tuttora un sfida per il clinico di campo a causa delle limitate possibilità di diagnostica per immagini nel cavallo (torace, addome) per via dei grossi diametri di questi distretti. Inoltre i pazienti equini sofferenti per patologie neoplastiche tendono a mostrare una sintomatologia non specifica come febbre, cachessia o una leggera anemia, la conta dei bianchi spesso si altera solo leggermente e le sindromi paraneoplastiche (come l’ipercalcemia) sono raramente presenti. Questa situazione potrebbe rendere estremamente difficoltoso giungere ad una diagnosi; il linfoma equino (linfosarcoma) rappresenta la patologia tumorale maligna più comune nel cavallo e può manifestarsi nella forma gastroenterica, cutanea, mediastinica o multicentrica (Fig.1).
A seconda della fase della malattia e della localizzazione del tumore potrebbe non essere effettuabile un campionamento adeguato per una diagnostica istopatologica.
Si è iniziato recentemente ad usare la timidina chinasi come marker per le patologie proliferative nella diagnostica dei tumori equini. Si tratta di un enzima cellulare che gioca un ruolo decisivo durante la sintesi di DNA, quando il nucleoside timidina viene incorporato nel DNA; questo è il motivo per cui la sua concentrazione nel siero è correlata in modo positivo diretto con il tasso di divisione cellulare. Dal momento che le patologie maligne del sistema ematopoietico e linfatico (linfoma, leucemia e mieloma multiplo) sono caratterizzate da un elevato tasso proliferativo, la timidina chinasi può essere misurata utilizzandola come un cosiddetto marker proliferativo. Bisogna tener conto nelle diagnosi differenziali che un’infiammazione grave potrebbe portare ad un leggero aumento della timidina chinasi, in questo caso dovrebbero essere valutate anche anche le proteine di fase acuta.
Un risultato negativo potrebbe non escludere comunque la presenza di una malattia tumorale sottostante.
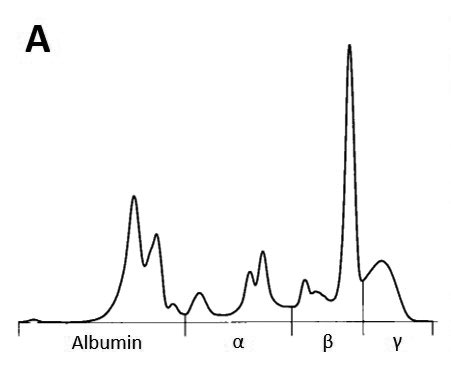
L’elettroforesi delle proteine sieriche potrebbe costituire un’opzione diagnostica aggiuntiva a basso costo in caso di sospetto tumorale. Le alterazioni monoclonali, spesso riguardanti la frazione beta o gamma, rappresentano il risultato della produzione eccessiva di una specifica immunoglobulina da parte di una plasmacellula clone e sono state descritte nelle malattie linfoproliferative (Fig. 2 A e B).
- Fig. 1: rilievi post mortem in una fattrice Islandese di 3 anni. Il soggetto presentava una storia clinica di febbre, epistassi e magrezza generale. La diagnostica di laboratorio mostrava una grave anemia (RBC 1.550 milioni, ht 0.08, Hb 54 g/L) con trombocitopenia (17 G/ L). Il linfoma è stato confermato istopatologicamente.
- Fig. 2A: Il grafico dell’elettroforesi delle proteine sieriche caratterizzato da un picco monoclonale nella frazione beta
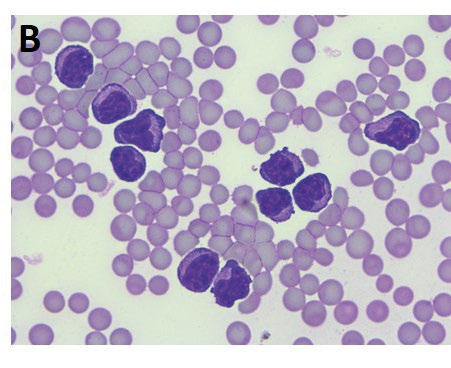
- Fig. 2B: Questo cavallo mostrava una grave leucocitosi con numerosi linfociti atipici nel sangue periferico, un elevato valroe di Amiloide sierica (850.15 μg/ml) ed un livello sierico di Timidina chinasi di 19.3 U/l (valore di riferimento < 3 U/l)
Se si sospetta una neoplasia epatica (p. es. un carcinoma epatocellulare) possiamo misurare la fetoproteina alpha 1 (AFP). Si tratta di una glicoproteina che viene prodotta in modo fisiologico nei puledri neonati fino all’età di un anno e mezzo ed è per questo motivo elevata anche nelle fattrici gravide. Negli adulti o nei soggetti non gravidi invece un aumento potrebbe indicare un tumore epatico, in quanto l’AFP risulta prodotta dalle cellule tumorali epatiche; pertanto possiamo riscontrarne dei livelli elevati anche in questi casi. La fosfatasi alcalina (AP) è utilizzata meno di frequente per la diagnosi dei tumori epatici. Un aumento delle attività enzimatiche della AP nel siero ha maggiori probabilità di riscontrarsi nel caso di tumori ossei (es. osteosarcoma), sebbene siano piuttosto rari nel cavallo.
Un tumore piuttosto frequente nelle cavalle invece è il tumore delle cellule della granulosa (GCT): una diagnosi può essere spesso effettuata in modo conclusivo attraverso la misurazione dell’ormone Antimülleriano (AMH).
Si tratta di una glicoproteina che influenza la differenziazione sessuale durante lo sviluppo embrionale ed è prodotta dalle cellule della granulosa durante lo sviluppo follicolare nelle cavalle mature sessualmente e dalle cellule del Sertoli nei maschi. L’ormone Antimülleriano può pertanto essere utilizzato come un marker di diagnostica di laboratorio non solo per la diagnostica tumorale ma anche per varie altre problematiche cliniche.
Per la diagnosi dei tumori delle cellule della granulosa l’AMH è dimostrato essere il marker diagnostico maggiormente sensibile (98%) a confronto dell’inibina (80 – 90%) e del testosterone (50%). Queste fattrici mostrano tipicamente dei segni clinici di anestro, livelli di progesterone molto bassi (< 1 ng/ml) ed un’ovaia ingrossata con un aspetto ecografico impressionante, a nido d’ape. L’ovaio controlaterale d’altro canto appare generalmente di dimensione molto ridotta. Spesso non risulta possibile una chiara differenziazione ecografica da altre patologie ovariche come l’ematoma ovarico, il teratoma od il cistoadenoma. In questi casi la determinazione dell’AMH può essere d’aiuto, dal momento che è prodotto in grandi quantità dalle cellule della granulosa. Se la determinazione dell’AMH non fornisce un risultato attendibile (es. se il tumore delle cellule della granulosa sta iniziando a svilupparsi), si consiglia di ritestare questo parametro dopo almeno 3/4 mesi. Una diagnosi di tumore delle cellule della granulosa attraverso la misurazione dell’AMH è possibile anche durante la gravidanza, dal momento che i livelli di questo ormone, a differenza del testosterone e dell’inibina, rimangono inalterati fino a gravidanza avanzata.
Anche nel ciclo normale della fattrice l’AMH non è soggetto a fluttuazioni significative e, al contrario del testosterone che può essere prodotto dalla corteccia surrenale, è prodotto solamente dall’ovaio medesimo. Nelle fattrici più anziane (con più di 20 anni) è possibile riscontrare un abbassamento del livello di AMH correlato alla diminuzione delle riserve follicolari (follicoli primordiali).
La determinazione dell’AMH può essere utile anche negli stalloni. Nei maschi, al contrario dell’estrone solfato, la determinazione dell’AMH è decisiva per la diagnosi di criptorchidismo indipendentemente dall’età e quindi rappresenta un utile biomarker per stabilire la presenza di tessuto testicolare. Il livello base di testosterone negli stalloni criptorchidi potrebbe essere basso o borderline e può fornire poche informazioni quando determinato come singola misurazione. Il testosterone deve quindi essere sempre misurato in modo dinamico tramite un test di stimolazione con hCG (valore di base e dopo stimolazione). A causa della sua lunga emivita (1 giorno e mezzo – 2 giorni) la misurazione dell’AMH dovrebbe essere determinata dopo almeno 2 settimane post castrazione, dal momento che dopo questo lasso di tempo le concentrazioni sieriche dovrebbero essersi abbassate ad un livello diagnostico. Prima che siano trascorsi questi 14 giorni, il testosterone appare un parametro maggiormente adatto dal momento che ha un’emivita molto più corta (circa 1 ora). Un livello molto basso di AMH in stalloni non criptorchidi potrebbe indicare una degenerazione testicolare o potrebbero essere dovuti alla normale fluttuazione stagionale con abbassamento in autunno/inverno. La degenerazione testicolare correlata all’età è più comune negli stalloni anziani, ma la misurazione dell’AMH non fornisce dati riguardo la fertilità del soggetto. D’altra parte livelli molto elevati, unitamente alla sintomatologia, potrebbero indicare un tumore delle cellule del Sertoli e dovrebbero essere chiariti tramite un esame istopatologico.
I biomarker non giocano un ruolo solamente nella diagnostica tumorale: se si sospetta la presenza di infiammazione, le proteine di fase acuta come l’amiloide sierica (SAA) od il fibrinogeno potrebbero essere utili nella valutazione della gravità di un’infiammazione non visibile clinicamente oppure per fornire una stima di un’efficacia terapeutica.
Generalmente, le proteine di fase acuta si dividono in negative, la cui concentrazione in circolo diminuisce durante la risposta di fase acuta (es. albumina) e positive che, a loro volta, aumentano durante l’infiammazione. Le proteine di fase acuta positive possono essere sia maggiori (che aumentano rapidamente da 10 a 1000 volte in poco tempo), che moderate (che aumentano lentamente da 5 a 10 volte con un plateau) o minori (con un aumento da 0,5 fino a 5 volte). La formazione delle proteine di fase acuta inizia durante la risposta di fase acuta all’infiammazione; si tratta di una reazione sistemica precoce non specifica rispetto al danno tissutale scatenato da un’ infezione (batterica, virale o parassitaria), da un trauma od una neoplasia. Oltre agli effetti locali e sistemici il rilascio dei mediatori dell’infiammazione – come le citochine pro-infiammatorie, stimola negli epatociti del fegato la sintesi delle proteine di fase acuta.
Nel cavallo la determinazione della SAA come la principale proteina di fase acuta sta cominciando ad essere utilizzata sempre maggiormente nella diagnostica clinica di laboratorio. La SAA è una apolipoproteina che da un lato recluta le cellule infiammatorie all’interno di un’area infiammata, ma dall’altro sopprime la proliferazione dei linfociti. Nei cavalli sani l’amiloide sierica è rilevabile in concentrazioni molto basse. Se è presente un agente nocivo, si verifica un rapidissimo (nell’arco di 6–12 ore) e forte aumento della concentrazione (da 100 – 1000 volte) ed anche un rapidissimo abbassamento quando la noxa viene rimossa (entro le 12 ora). La SAA risulta essere un marker molto sensibile della fase precoce dei processi infiammatori e può quindi fornire un aiuto importante nella diagnosi, prognosi e nel monitoraggio della patologia infiammatoria. I livelli di SAA possono essere misurati specialmente quando è essenziale una rapida azione, come per esempio nella medicina neonatale, per rilevare la presenza di setticemia, polmonite batterica od artrite settica ad uno stadio precoce. I livelli di SAA possono essere inoltre d’aiuto nel differenziare tra infezione virale e batterica, ma dovrebbero sempre essere interpretate nel contesto dell’esame clinico generale e di altri parametri di laboratorio, dal momento che la SAA è una proteina di fase acuta non specifica. Dei livelli leggermente elevati possono essere riscontrati dopo eventi stressanti, trasporto, vaccinazione o sforzi pesanti. In ogni caso un aumento di SAA non dovrebbe mai costituire l’unico criterio per instaurare un trattamento antibiotico. Devono infatti essere considerati inoltre la conta delle cellule della serie bianca, la chimica clinica e la valutazione di altri marker infiammatori e naturalmente gli esami clinico e batteriologico.
Il fibrinogeno, che è una proteina di fase acuta moderata, è anch’esso utilizzato come mezzo diagnostico in medicina equina. Confrontandolo con la SAA, aumenta solamente di 1 o 2 volte nelle prime 24 ore dopo la noxa patogena e ha un picco circa dopo 48 ore. Il Fibrinogeno può rimanere elevato per alcune settimane e non è pertanto ugualmente sensibile per monitorare la terapia. Infine, è misurabile solamente da plasma da sodio citrato.
Una diagnosi veloce e precoce non è solamente attinente all’infiammazione acuta ma anche per organi con tasso rigenerativo basso come per esempio il muscolo cardiaco. Un biomarker utile per la necrosi acuta del miocardio è la troponina I, che può essere utilizzata come parametro cardiaco specifico nel cavallo. Le troponine cardiache sono delle proteine che giocano un ruolo importante nella regolazione delle contrazioni e del rilassamento del miocardio. Se le cellule sono danneggiate, possono essere rilevati dei livelli sierici di troponina cardiaca elevati dopo circa 5–7 ore dall’evento patologico. Le cause possono essere varie: virali, batteriche, patologie congenite del cuore, carenze, tossine ed anche neoplasie.
Quindi, nel complesso abbiamo a disposizione molti biomarker estremamente sensibili e differenti nella diagnostica clinica di laboratorio che possono, separatamente od in combinazione, fornire un’idonea assistenza nella pratica clinica sia in termini di diagnosi, di prognosi che nel presagire il successo terapeutico come pure per supportare le corrette decisioni del caso.
Svenja Möller