Ormai il gruppo di esperti Laboklin è diventato familiare. Gli esperti invitati affrontano domande inerenti a determinate patologie in una discussione moderata.
Abbiamo messo in luce per te alcuni aspetti interessanti emersi durante il confronto sull’anemia emolitica immunitaria (IMHA).
Al gruppo di esperti sul tema IMHA hanno partecipato: la prof.ssa dott.ssa Barbara Kohn della Libera Università di Berlino – l’ematologia è uno dei suoi focus di ricerca; la dott.ssa Esther Haßdenteufel dell’Università Justus Liebig di Giessen – in qualità di medico di terapia intensiva, si occupa spesso di pazienti IMHA; la dott.ssa Barbara Glanemann del Royal Veterinary College in Inghilterra – è stata determinante nella stesura della dichiarazione di consenso ACVIM sull’IMHA; la dott.ssa Annemarie Baur-Kaufhold che dirige il reparto di ematologia presso Laboklin; il prof. dott. Wolfgang Bäumer che è direttore dell’Istituto di farmacologia e tossicologia presso il Dipartimento di Medicina Veterinaria della Libera Università di Berlino.
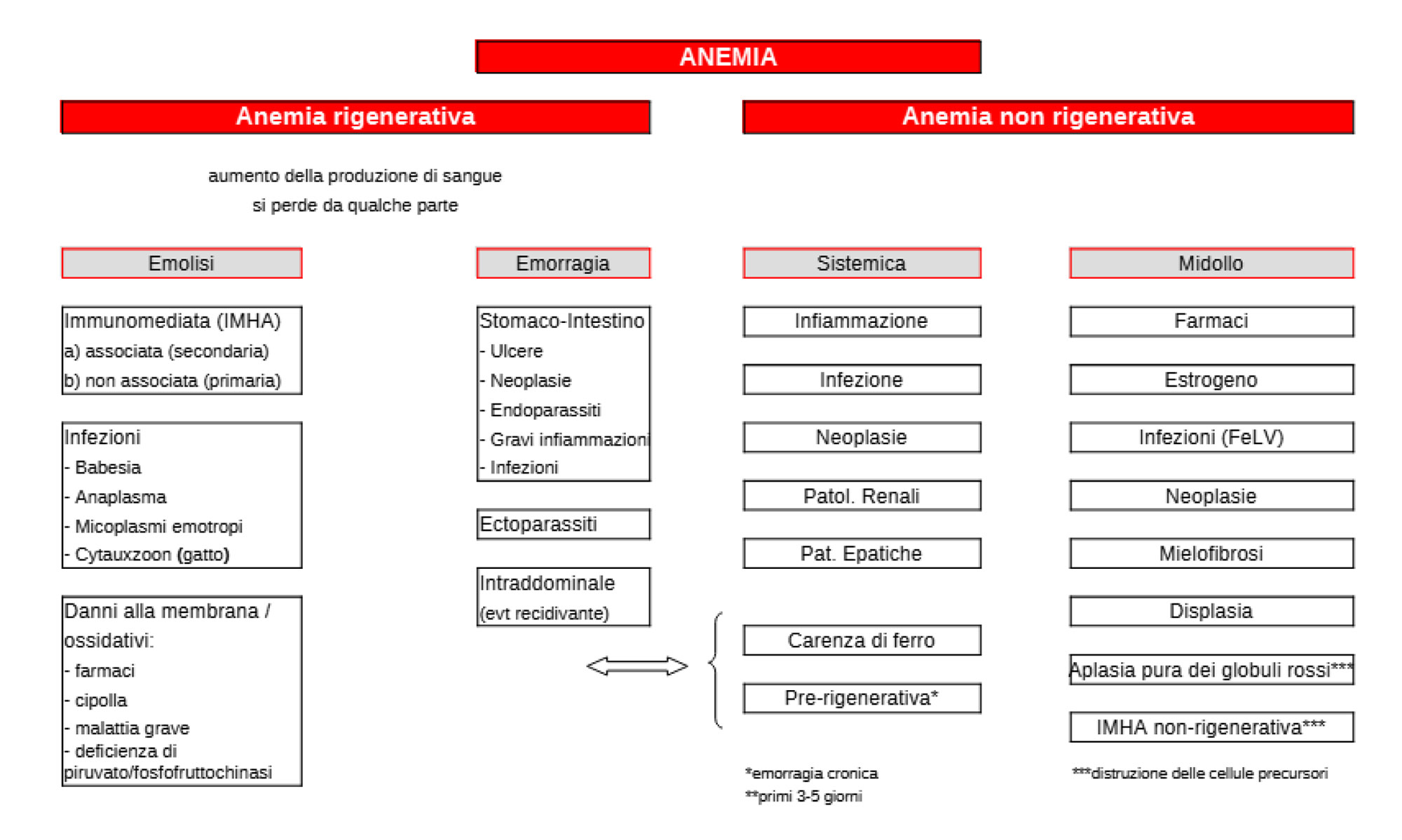
Per introdurre il tema dell’anemia, la dott.ssa Glanemann fornisce una panoramica delle diverse forme di anemia. Lei le divide in anemie rigenerative e non rigenerative. La rigenerazione avviene quando sono presenti i reticolociti. Le possibili cause includono perdita di sangue o emolisi.
L’emolisi può verificarsi attraverso vari meccanismi. La forma più conosciuta di emolisi è l’anemia emolitica immunomediata (IMHA), in cui il sistema immunitario del corpo attacca gli eritrociti. Ma esistono anche alcuni agenti infettivi che distruggono gli eritrociti. Inoltre, il danno alla membrana degli eritrociti può causarne la lisi. Ciò è stato descritto in processi ossidativi (ad esempio intossicazione da cipolla o zinco) o in malattie congenite (ad esempio deficit di piruvato chinasi).
Le anemie non rigenerative sono solitamente causate da malattie dei sistemi organici (comprese le endocrinopatie), infiammazioni o problemi al midollo osseo.
Le anemie che si verificano in modo molto acuto (entro 3-5 giorni) non possono essere ancora rigenerative perché il midollo osseo ha bisogno di tempo per reagire (pre- rigenerativa). Ciò vale anche per l’emolisi acuta.
Inoltre esistono forme di IMHA in cui vengono attaccate le cellule precursori della serie eritroide. In questi casi mancano i segni di rigenerazione nel sangue tipici dell’emolisi.
-
Fig. 1: Diagnosi differenziali di anemia
Immagine: Dr. Jennifer von Luckner
-
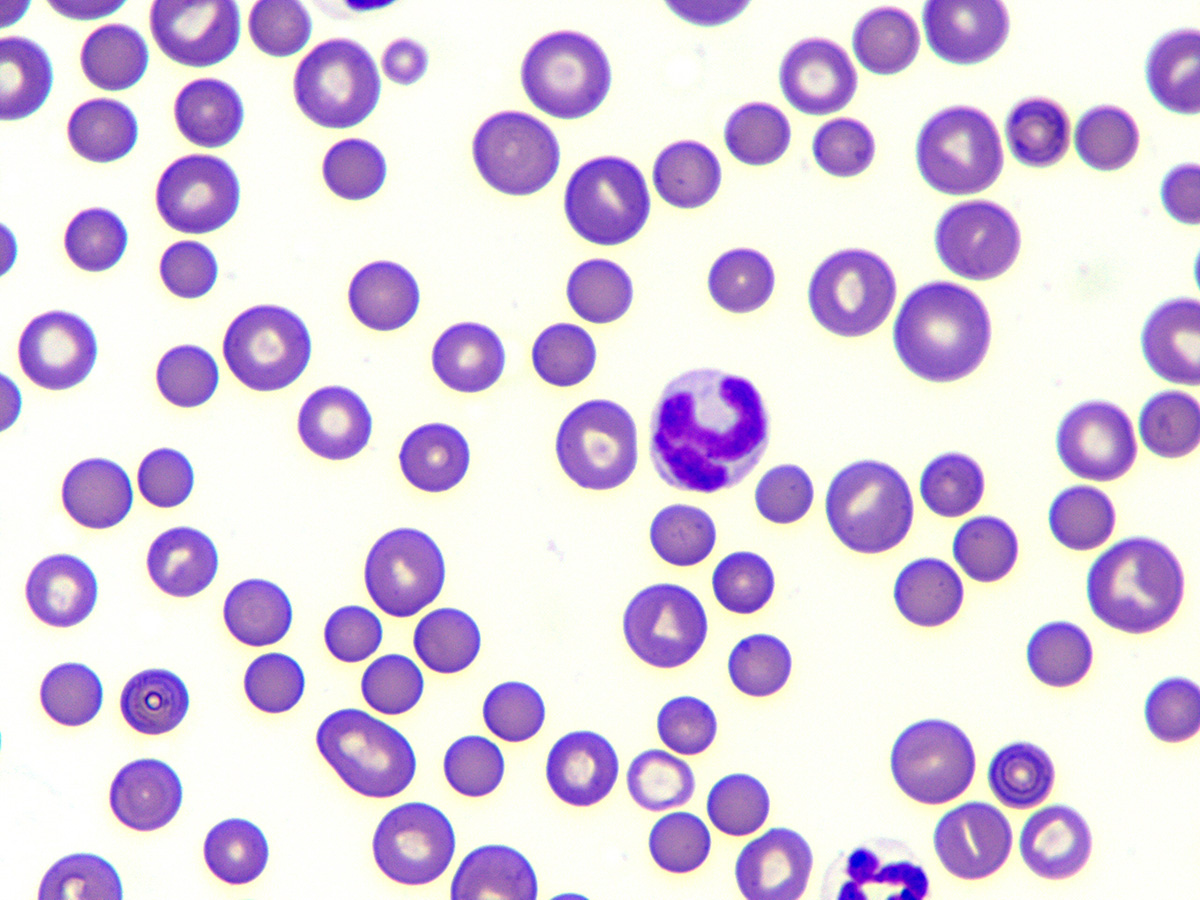
Fig. 2: Sferociti
Immagine: Laboklin
-
Fig. 3: Autoagglutinazione
Immagine: dott.ssa Jennifer von Luckner
La dott.ssa Baur-Kaufhold aggiunge che in queste forme non rigenerative di IMHA, l'”aplasia pura dei globuli rossi” (PRCA) e l’IMHA mirato al precursore (= PIMA, chiamato anche IMHA non rigenerativo = nrIMHA) vengono differenziati in base ai risultati del midollo osseo. Nella PRCA, l’ipo/aplasia eritroide si riscontra nel midollo osseo, mentre nella PIMA/nrIMHA è presente l’iperplasia eritroide. La prof.ssa Kohn aggiunge che la PRCA è più comunemente osservata nei gatti che nei cani.
La dott.ssa Baur-Kaufhold affronta la questione della differenza tra emolisi intravascolare ed extravascolare e spiega che durante l’emolisi intravascolare gli eritrociti vengono distrutti direttamente nel flusso sanguigno.
L’emoglobina rilasciata nel flusso sanguigno diventa visibile quando il siero e l’urina diventano rossi. Al contrario, l’emolisi extravascolare distrugge gli eritrociti nel fegato, nella milza e/o nel midollo osseo.
La dott.ssa Glanemann aggiunge che l’IMHA intravascolare è spesso più grave e ha una prognosi peggiore rispetto all’IMHA extravascolare.
La prof.ssa Kohn riferisce che la formazione e la distruzione di nuovi eritrociti possono essere bilanciate. Tali forme croniche e prolungate sono più difficili da diagnosticare. In questo caso è particolarmente importante escludere altre cause di anemia (come ad esempio emorragie nascoste). Anche il test di Coombs può essere utile.
È interessante notare a questo punto che l’IMHA protratta è riscontrata più frequentemente nei gatti.
In alcuni pazienti con IMHA, oltre all’anemia è presente una concomitante trombocitopenia.
La dott.ssa Glanemann spiega che si parla di sindrome di Evans quando sia la trombocitopenia che l’anemia si basano sulla distruzione cellulare immunomediata.
Tuttavia, le piastrine vengono spesso consumate come parte della coagulazione intravascolare disseminata (DIC) che accompagna l’IMHA. La distinzione non è sempre facile. Come regola generale: la trombocitopenia immunomediata (IMTP) di solito provoca una trombocitopenia molto grave, mentre nella DIC è più moderata. Poiché l’IMTP raramente si verifica senza anticorpi antipiastrinici rilevabili, la loro determinazione può essere indicativa.
La prof.ssa Kohn spiega che l’IMHA può essere primaria (detta anche: non associato) o secondaria (detta anche: associato). Per restare con i vecchi termini, primaria significa che non è stato possibile trovare alcun possibile trigger per l’IMHA. Secondaria, significa che è stata rilevata una possibile malattia sottostante (associata) o un fattore scatenante. Fondamentalmente, qualsiasi malattia e molti fattori esterni possono innescare l’IMHA. In ogni caso è necessario un esame molto accurato, compresa l’imaging.
Per quanto riguarda il tema delle vaccinazioni, la dott.ssa Glanemann sottolinea che non esistono ancora prove concrete che le vaccinazioni possano attivare l’IMHA. In relazione all’elevato numero di vaccinazioni, solo pochissimi casi di IMHA possono essere collegati alle vaccinazioni. La prof.ssa Kohn interviene affermendo che statisticamente è certamente così: in singoli casi l’IMHA avviene in un collegamento temporale diretto con la vaccinazione e quindi la vaccinazione potrebbe essere stata un possibile fattore scatenante.
Sorge quindi la domanda su come dovrebbero essere gestite le ulteriori vaccinazioni per tali pazienti. La prof.ssa Kohn consiglia di attenersi scrupolosamente alle raccomandazioni della commissione permanente per le vaccinazioni di medicina veterinaria (StIKo Vet) e di effettuare le vaccinazioni di base solo dopo una valutazione individuale del rischio. Lei esegue i controlli del titolo per il parvovirus e il cimurro e vaccina il paziente solo se non è presente il titolo Ac. Sfortunatamente, il monitoraggio del titolo non è affidabile per verificare la protezione vaccinale contro la leptospirosi, quindi si raccomanda una rivaccinazione annuale.
La dott.ssa Baur-Kaufhold offre una panoramica sulla diagnostica. In primo luogo, occorre prestare attenzione alle indicazioni di possibili processi non immunomediati (ad esempio cipolla, zinco, soggiorno all’estero). Anche la razza può essere interessante. Il deficit di piruvato chinasi è molto raro nei gatti somali e abissini come anche in altre razze di gatti come il Maine Coon e in alcune razze di cani. Sebbene sia congenito, può diventare clinicamente evidente solo nel corso della vita. D’altra parte, ci sono razze di cani come il Cocker Spaniel che sembrano sviluppare più frequentemente l’IMHA più spesso. Uno striscio di sangue può identificare il danno ossidativo agli eritrociti (ad esempio Heinz Bodies).
In ogni caso, dovrebbero essere esclusi gli agenti infettivi. La prof.ssa Kohn controlla quindi regolarmente i seguenti agenti patogeni nei pazienti IMHA:
- nei cani esamina sempre Anaplasma e Babesia (utilizzando la PCR – la sierologia mostra solo il contatto e può anche risultare negativa in caso di infezione molto precoce). Per i cani con storia di viaggi/importazioni viene effettuato anche un profilo viaggio completo (anticorpi contro Ehrlichia canis e Leishmania infantum, antigeni di Dirofilaria immitis e PCR per filaria o test di Knott, PCR per Hepatozoon spp.).
- nel gatto esamina: micoplasmi emotropi e piroplasmi (tra cui Babesia e Cytauxzoon ) mediante PCR, FeLV (incluso sempre la PCR per il provirus) e FIV.
Segni tipici di IMHA, spiega la dott.ssa Baur-Kaufhold, sono: sferociti (Fig. 2) nello striscio di sangue (cane), presenza di autoagglutinazione e test di Coombs positivo. Se si sospetta una forma non rigenerativa di IMHA, è sempre necessario eseguire un esame del midollo osseo dopo aver escluso altre possibili cause di anemia non rigenerativa.
Riferisce inoltre che gli sferociti nascono dopo la fagocitosi parziale da parte dei macrofagi. Gli sferociti sono più piccoli dei normali eritrociti e non hanno una schiaritura centrale. In generale si afferma che una proporzione di 5 sferociti per campo ad alta potenza (hpf) è considerata sospetta. Più sferociti ci sono, più probabile è l’IMHA. I singoli sferociti, tuttavia, non dovrebbero essere sovrainterpretati, poiché anche altre malattie possono portare alla loro formazione. Nei gatti, gli sferociti non vengono normalmente utilizzati per scopi diagnostici perché questa specie ha naturalmente eritrociti relativamente piccoli con una luce centrale scarsa o nulla.
L’autoagglutinazione è spesso visibile nella provetta sotto forma di sangue che appare friabile. Se i globuli rossi agglutinati non sono già evidenti, è necessario eseguire un test su vetrino: 1 goccia di sangue viene mescolata con 1-2 gocce di NaCl ed esaminata per verificare la presenza di granuli fini o, al microscopio, di eritrociti attaccati tra loro (Fig. 3). È corretto lavare gli eritrociti lavati prima di verificare l’autoagglutinazione, perché reazioni aspecifiche portano a reazioni simili come aspetto all’agglutinazione.
La prof.ssa Kohn continua con il test di Coombs: il test di Coombs viene utilizzato per verificare le reazioni immunitarie contro gli eritrociti del corpo. Per fare ciò, il campione di sangue viene esaminato per l’agglutina-zione degli eritrociti dopo l’aggiunta di sieri test contenenti anticorpi. Su base scientifica, è possibile fare una distinzione tra i diversi anticorpi coinvolti. Per l’uso pratico quotidiano sono sufficienti i cosiddetti test polivalenti per la diagnosi IMHA. Un risultato positivo indica un evento immunologico. La dott.ssa Glanemann sottolinea che possono verificarsi risultati falsi negativi. Un test di Coombs negativo quindi non esclude l’IMHA. La dott.sa Baur-Kaufhold conferma che il test di Coombs non può sempre essere valutato, ad esempio, se c’è autoagglutinazione degli eritrociti, il test di Coombs basato sull’agglutinazione non può essere letto. Altri motivi includono l’invio di materiale errato e la distruzione degli eritrociti in un campione di sangue non più fresco, una conservazione inadeguata o a causa del trasporto.
Alla domanda se la concentrazione di bilirubina aumenta sempre durante l’IMHA, la dott.ssa Glanemann risponde che la bilirubina viene rilasciata dagli eritrociti distrutti.
L’iperbilirubinemia diventa visibile solo quando il fegato non è in grado di scomporla. Si osserva quasi sempre nell’emolisi intravascolare. Questo non è sempre il caso dell’emolisi extravascolare (soprattutto nelle forme protratte). La gravità dell’iperbilirubinemia è rilevante dal punto di vista prognostico. Nei gatti, l’IMHA si verifica spesso senza iperbilirubinemia, soprattutto nell’nrIMHA.
La sezione successiva tratta della terapia. La dott.ssa Haßdenteufel spiega quando è necessaria una trasfusione di sangue. Spesso viene fornito un valore guida dell’ematocrito del 12%. Tuttavia, questo valore è inteso principalmente come guida. Se l’anemia si è sviluppata molto rapidamente (di solito in fase pre-rigenerativa), il paziente ha avuto poco tempo per adattarsi abituarsi al basso trasporto di ossigeno. In questi casi può essere necessario effettuare la trasfusione con un valore di ematocrito più alto, mentre animali con anemia da molto tempo possono tollerare anche un ematocrito più basso. In ogni caso, è importante valutare il singolo paziente per segni di carenza acuta di ossigeno come tachicardia e polipnea. Se questi sono presenti, è indicata una trasfusione di sangue.
In tema di xenotrasfusione nei gatti (trasfusione di sangue di cane), la dott.ssa riferische che ciò può avvenire in una situazione di emergenza, quando non è possibile trovare un donatore adatto.
I gatti rispondono bene e può essere un vero salvavita. Tuttavia, è importante notare che gli eritrociti del cane vengono distrutti nel giro di pochi giorni dalla trasfusione. Aiutano quindi solo a breve termine. Inoltre, il gatto non deve mai più ricevere una trasfusione di sangue di cane, poiché gli anticorpi si formano molto rapidamente e portano ad una reazione trasfusionale fulminante se la trasfusione viene ripetuta. Questo deve essere assolutamente comunicato ai proprietari!
La terapia immunosoppressiva viene solitamente iniziata con prednisolone. Il prof. Bäumer concorda con gli altri esperti nel ritenere che si tratti di uno standard adeguato.
Nelle forme gravi, soprattutto quelle con emolisi intravascolare, grave iperbilirubinemia o grave autoagglutinazione, gli esperti preferiscono intervenire precocemente con un secondo immunosoppressore.
Concordano con il fatto che, se l’ematocrito continua a scendere entro 48 ore dall’inizio della terapia e/o il paziente necessita di trasfusioni multiple, dovrebbe essere utilizzato un secondo immunosoppressore.
Ciò è raccomandato anche se si prevede che il paziente manifesterà gravi effetti collaterali al prednisolone e si desidera una riduzione più rapida dei glucocorticoidi a lungo termine. Questo è spesso il caso dei cani di grossa taglia con un peso corporeo > 25 kg o delle razze di gatti con predisposizione al diabete mellito. Si è riluttanti tuttavia a somministrare un terzo immunosoppressore, poiché ciò porta ad un aumento del rischio di effetti collaterali (inclusa la sepsi) con benefici non chiari.
Alcuni colleghi chiedono se il prednisolone può essere utilizzato prima che siano disponibili i risultati per gli agenti patogeni infettivi. In caso di dubbio, la prof.ssa Kohn consiglia di iniziare con la terapia immunosop-pressiva con prednisolone. Se c’è un forte sospetto ad es. di Anaplasma o Babesia. potrebbe essere necessario somministrare doxiciclina o imidocarb.
L’uso delle immunoglobuline è spesso discusso in caso di fallimento del trattamento. La dott.ssa Glanemann sottolinea che non ci sono prove della loro efficacia nell’IMHA. Tuttavia, se nessun’altra misura ha successo, è possibile eseguire una prova con le immunoglobuline prima o dopo una splenectomia, che è considerata anche l'”ultima risorsa” per l’IMHA.
Parallelamente alla terapia immunosoppressiva, il Consensus Statement di ACVIM raccomanda il trattamento con anticoagulanti. La dott.ssa Haßdenteufel conferma che i pazienti affetti da IMHA tendono a formare trombi, che possono portare a disturbi di perfusione.
Questo vale anche se è presente trombocitopenia. Il Consensus Statement di ACVIM specifica un limite inferiore di 30.000 piastrine/μL per la terapia antitrombotica. I derivati dell’eparina (eparina non frazionata e a basso peso molecolare) hanno la priorità rispetto al clopridogrel.
Tuttavia, la terapia con eparina deve essere controllata mediante regolari controlli della coagulazione o con l’ausilio della determinazione del fattore X. La dott.ssa Glanemann sottolinea che ciò non è realistico in condizioni pratiche. Lei stessa ha avuto buone esperienze con clopidogrel. Il vantaggio di clopidogrel è la possibilità di somministrazione orale. Secondo il Consensus Statement di ACVIM, la terapia dovrebbe proseguire per tutta la durata del trattamento con prednisolone.
Infine, riguarda la durata e il monitoraggio della terapia, la prof.ssa Kohn sottolinea che la terapia dovrebbe durare diversi mesi. In caso di recidive può essere necessario un trattamento permanente. Questo è particolarmente comune con i gatti. La dott.ssa Glanemann controlla la terapia sulla base dell’ematocrito, spesso insieme alla determinazione della conta dei reticolociti. Se i reticolociti diminuiscono mentre l’ematocrito è stabile o in aumento, questo è un buon segno. Superata la malattia e sospesi tutti i farmaci, è consigliabile controllare i valori ematologici per altre 4 settimane per confermare che vi sia realmente una remissione. Successivamente non sono necessari ulteriori esami del sangue. Il tasso di recidiva per i cani con IMHA primario/non associato è di circa il 15-20%.
Dott.ssa Jennifer von Luckner