Nei cani i batteri colonizzano molte zone del corpo come la superficie della pelle e tutte le membrane mucose direttamente esposte all’ambiente (p.es. il tratto respiratorio o quello urogenitale) (fig. 1). L’insieme di tutti questi microrganismi è chiamato microbioma.
Il distretto maggiormente colonizzato dal microbioma è il tratto gastro-intestinale. A partire da aree prive di germi, come lo stomaco e il duodeno, la concentrazione di batteri aumenta fortemente dall’intestino tenue al colon (1011-1012 batteri / gr. di feci). Studi recenti mostrano che il numero di microbi localizzati nel colon può superare quello delle cellule del corpo della cellula ospite di un fattore 10. Più del 25% delle feci dei cani è costituito da batteri intestinali: gli anaerobi ne costituiscono il 99%, una quota significativamente elevata.
Considerando la totalità di tutti i processi metabolici di questo complesso di batteri, il microbioma intestinale ha una capacità metabolica maggiore rispetto al fegato.
Importanza e funzione della flora intestinale
Il contributo che i microbi intestinali portano alla salute del soggetto, è ora confermato da un gran numero di studi scientifici. Si è scoperto che tutta una serie di complessi processi metabolici e immunoregolatori sono influenzati positivamente dalla flora intestinale.
1. Resistenza alla colonizzazione
I batteri commensali intestinali costituiscono un’importante barriera microbica e prevengono l’insediamento e la moltiplicazione di germi enteropatogeni come Campylobacter o di germi opportunisti come Candida albicans. Questa funzione è principalmente mediata da tre processi:
- occupazione di recettori sulla membrana mucosa
- inibizione della crescita del patogeno grazie alla secrezione di metaboliti batteriostatici o microbicidi
- concorrenza per nutrienti, vitamine e fattori che ne promuovono la crescita.
2. Approvvigionamento di sostanze nutritive
Una microflora ben consolidata promuove il metabolismo e la circolazione della mucosa intestinale. I prodotti della degradazione batterica di carboidrati e proteine passano per diffusione nelle cellule della mucosa del colon, coprendo oltre il 50% del fabbisogno energetico degli enterociti del colon stesso. Inoltre, gli acidi grassi a corta catena secreti dai batteri, promuovono la peristalsi intestinale e quindi sostengono la funzione digestiva.
-
Fig. 1. Biofilm batterico con microbiota.
Fonte: Lewis Lab, Northeastern University. Immagine di: Anthony DʼOnofrio, William H. Fowle, Eric J. Stewart e Kim Lewis.
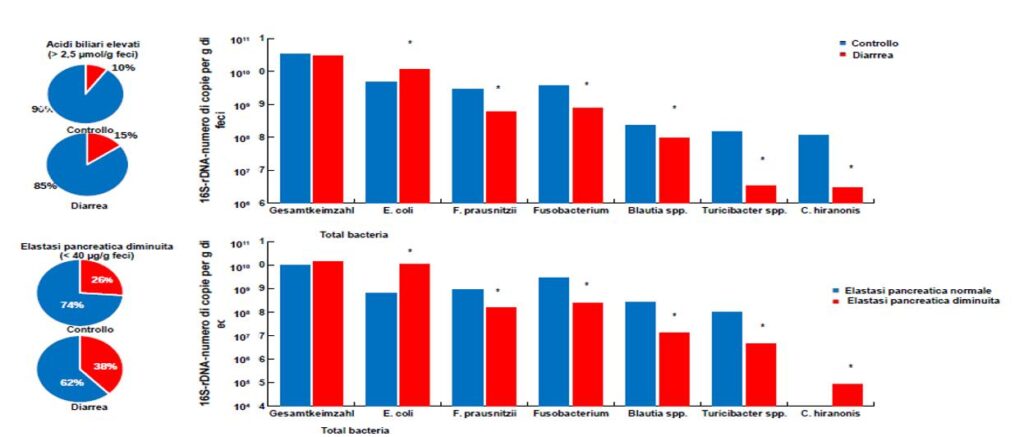
- Fig. 2 Prevalenza di alti livelli di acidi biliari e bassi valori di elastasi pancreatica in cani con diarrea – confrontati con cani asintomatici (a sinistra) e composizione della microflora in cani con diarrea (in alto) e insufficienza digestiva (in basso) confrontati con il gruppo di controllo (n=30, p<0,05, Wilcoxon-Mann-Whitney- Test)
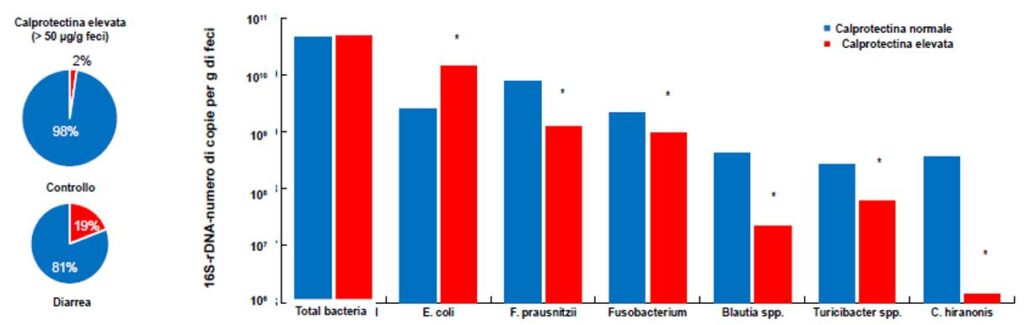
- Fig. 3 Prevalenza di valori elevate di calprotectina fecale in cani con diarrea, confrontati con cani asintomatici (a sinistra) e composizione della microflora in cani con alterazioni inflammatorie della mucosa confrontati con un gruppo di controllo. (n=25, p<0,05, Wilcoxon-Mann-Whitney-Test)
-
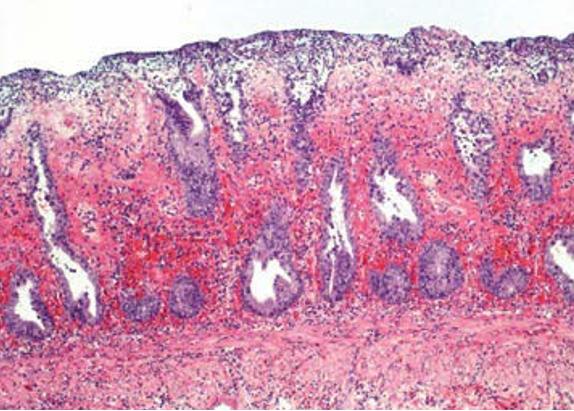
Fig. 4. Proctite acuta emorragica in un cane (colorazione ematossilina-eosina, 100x).
Fonte: Dr. Ulrike Schwittlick, Laboklin GmbH & Co. KG
3. Sistema immunitario collegato all’intestino
La flora intestinale è particolarmente importante perché sostiene le difese immunitarie dell’ospite oltre a fornirgli i nutrienti necessari. Anche la semplice presenza del microbiota intestinale contribuisce ad un costante allenamento del sistema immunitario intestinale, mantenendo attiva la difesa immunologica contro i germi estranei.
Inoltre, gli agenti patogeni vengono rimossi attivamente grazie alla stimolazione della sintesi di peptidi antimicrobici come le β-defensine e le immunoglobuline (sIgA).
Disbiosi intestinale
Nel caso di squilibri batterici a livello intestinale, la microflora non è in grado di soddisfare i suoi compiti benefici e protettivi sulla mucosa. Una conseguenza di ciò è la riduzione della resistenza alla colonizzazione con conseguente proliferazione di patogeni obbligati o facoltativi come batteri, virus, funghi e parassiti. A causa della ridotta funzionalità della barriera mucosale, gli antigeni, le endotossine e i metaboliti ad azione centrale come le istamine, possono ad esempio passare dal lume intestinale nel corpo e provocare o intensificare i meccanismi patogenetici. Questi includono non solo disturbi gastrointestinali come diarrea, stitichezza e malattie infiammatorie intestinali, anche la comparsa delle sindromi patologiche atopiche come intolleranze alimentari, gli eczemi e i problemi del mantello sono favoriti dalla stimolazione immunologica eccessiva.
Diagnostica e interpretazione
Il primo passo per arrivare ad una diagnosi in corso di disturbi gastrointestinali, come per esempio in presenza di diarrea ricorrente, è l’analisi culturale microbiologica delle feci. Questa consente un’identificazione rapida ed economica di molti batteri enteropatogeni come Salmonella, Yersinia e Campylobacter e di batteri patogeni facoltativi come Klebsiella o E. coli emolitico. Inoltre, in molti casi è consigliata anche l’analisi dei marcatori mucosali, infiammatori e digestivi come la calprotectina fecale, l’alfa-1-antitripsina, gli acidi biliari e l’elastasi pancreatica canina (fig. 2). In ogni caso, dovrebbero venire escluse anche cause parassitarie, mediante esame microscopico o immunologico delle feci.
Se queste indagini non forniscono esiti di particolare rilevanza, alla diagnosi differenziale può venire in aiuto un’analisi basata sulla biologia molecolare della flora fecale. Un gran numero di batteri anaerobi con proprietà antinfiammatorie, protettive e nutritive per la mucosa (ad es. Faecalibacterium prausnitzii) sono difficili o addirittura impossibili da coltivare. Le indagini microbiologiche convenzionali possono rilevare quindi solo una piccolissima parte del microbiota intestinale (<1%). Di conseguenza, le affermazioni che possono essere fatte con l’aiuto di tali analisi, riguardanti l’apporto metabolico delle cellule della mucosa e lo stato attuale della barriera, risultano abbastanza inadeguate.
Basandosi sui metodi biologici molecolari di analisi dei geni 16S-rRNA, i batteri possono venire identificati e quantificati indipendentemente dalle loro condizioni di coltura. Recentemente sono stati pubblicati studi su cani con enteropatie acute e croniche, nei quali sono stati identificati diversi gruppi batterici, principalmente anaerobi obbligati, la cui quantità era significativamente diversa da quella di un gruppo di controllo sano. Queste differenze rendono tali germi adatti ad essere presi come biomarcatori per le indagini sulla disbiosi intestinale. Sulla base di questi risultati, è stato possibile realizzare una metodica di rilevamento in tempo reale basata sulla PCR, adatta in caso di dubbio di disbatteriosi intestinale. Sono state studiate e quantificate le seguenti specie batteriche: Escherichia coli, Faecalibacterium prausnitzii, Fusobacteria spp., Blautia spp., Turicibacter spp., Clostridium hiranonis così come il numero totale di germi presenti nell’intestino (fig. 2).
Indicazioni per un’analisi di disbiosi
In quali casi è utile un esame per testare una eventuale disbiosi intestinale? Qui di seguito i risultati di studi interni su animali per i quali era stata esclusa la presenza di infezioni da batteri enteropatogeni, virus o endoparassiti.
1. Disturbi digestivi con insufficienza pancreatica esocrina
In questi casi vediamo animali con ridotti livelli di elastasi pancreatica nel 38% di tutti i casi di diarrea. L’immagine della flora intestinale corrisponde a quella di una disbiosi con un numero significativamente ridotto di batteri protettivi per la mucosa e antiinfiammatori come Faecalibacterium prausnitzii (ridotto fino a 10 volte). Al contrario, il numero di germi con potere proinfiammatorio come coli proteolitico, risulta marcatamente aumentato (fig. 2).
Le ragioni di ciò sono molteplici e tutt’ora ancora oggetto di ricerche a causa delle complesse correlazioni. Un fattore di selezione nella composizione del microbiota è rappresentato molto probabilmente dalla situazione metabolica alterata, causata da una difettosa attività digestiva in combinazione con un transito intestinale patologicamente accelerato. Un aumento del contenuto di carboidrati facilmente digeribili, proteine e grassi nell’intestino tenue e nella zona del colon, favorisce la crescita di germi e batteri responsabili della fermentazione con proprietà proinfiammatorie.
2. Processi infiammatori con aumento della concentrazione di calprotectina fecale
Nel 19% dei casi di aumento della calprotectina fecale vediamo cambiamenti nella consistenza fecale. L’analisi della microflora per i germi marcatori prescelti, ha rivelato cambiamenti significativi rispetto a quella presente nei cani sani. I cambiamenti risultavano simili a quelli presenti nell’insufficienza pancreatica esocrina. La differenziazione della genesi non è attualmente possibile a causa del numero limitato di campioni esaminati e sembra essere improbabile anche in futuro nonostante un numero sempre maggiore di animali che potranno venire analizzati.
La causa scatenante in questo caso potrebbe essere, tra le altre cose, una maggiore secrezione di proteine infiammatorie nel lume intestinale.
Quindi, anche senza disturbi digestivi o senza fonti esterne di proteine (mangimi ad alto contenuto proteico), l’equilibrio batterico può lasciare spazio ad un disordine intestinale con crescita proteolitica eccessiva (fig. 3 e 4).
Disbiosi intestinale: terapia
Nel caso in cui venga confermata una disbiosi intestinale, quali terapie risultano utili? Dopo il trattamento sintomatico iniziale con sostanze antinfiammatorie e di sostegno per la mucosa come gli acidi umici, la zeolite o l’argilla curativa, è da valutare anche l’uso di rimedi terapeutici microbiologici.
Sebbene non sia ancora possibile un’integrazione diretta del microbiota anaerobico come Faecalibacterium prausnitzii, Blautia o Turicibacter, bisogna tenere anche presente che, date le complesse interazioni all’interno microbioma, non deve essere preso in considerazione necessariamente un singolo gruppo batterico. Qualsiasi interferenza con il microbioma intestinale, sia attraverso la modificazione della dieta, sia con l’integrazione alimentare con prebiotici o probiotici, influisce direttamente o indirettamente con ogni singolo componente batterico. Pertanto, l’uso di preparati microbiologici può migliorare significativamente i sintomi clinici così come può prevenire il verificarsi di recidive. Pertanto, anche l’immunoterapia orale autologa con autovaccini risulta particolarmente adatta per migliorare la barriera immunologica e mucosale nei casi di carente proliferazione batterica.
Sommario
Nonostante le correlazioni causali siano in gran parte ancora oggetto di ricerca, lo studio della composizione microbica delle feci canine fornisce utili informazioni, riflettendo l’insieme di tutti i fattori che influenzano l’intestino. Grazie alla metodica di biologia molecolare su cui è basato il nuovo profilo per disbiosi, è possibile quantificare i batteri anaerobi e aerobi chiave del microbiota intestinale, utilizzando metodi moderni indipendenti dalla cultura. Si potranno così anche rilevare rapidamente e facilmente i disbatteri intestinali. I fattori che suggeriscono di procedere con un’analisi per disbiosi, sono le malattie gastrointestinali di origine sconosciuta (diarrea cronica, flatulenza, stitichezza, ecc.), i disturbi del sistema immunitario (allergie alimentari, dermatite atopica, problemi al mantello) e le immunodeficienze.
Come procedura non invasiva, il profilo per disbiosi risulta anche utile per il follow-up dopo terapie antinfiammatorie nel caso di malattie infiammatorie intestinali acute e croniche nonché per la valutazione della compromissione dell’ecosistema intestinale dopo una terapia antibiotica.
Con l’aggiunta, nel profilo per disbiosi, della determinazione dei marcatori di mucosa e dell’infiammazione (come calprotectina e alfa-1-antitripsina), dell’indagine micologica e microscopica per parassiti, possono venire rilevate simultaneamente, facilmente e rapidamente un gran numero di noxae mucosali e di cause di disturbo della barriera intestinale.