Le specie di vermi polmonari più importanti nei cani e nei gatti si riferiscono alla superfamiglia dei nematodi Metastrongyloidea, i cui stadi adulti vivono nei polmoni dei loro ospiti.
Esistono anche vermi della famiglia Trichuridae che parassitano anche le vie respiratorie.
In questo approfondimento presentiamo le specie più importanti a livello europeo e indaghiamo le diverse opzioni diagnostiche.
Mentre Angiostrongylus (A.) vasorum, Crenosoma (Cr.) vulpis, Oslerus (O.) osleri e Filaroides (F.) hirthi infettano principalmente i canidi selvatici ma anche i cani domestici, Aelurostrongylus (Ael.) abstrusus e Troglostrongylus (T.) brevior prediligono i gatti selvatici e quelli domestici.
Capillaria (C.) aerophila (sin. Eucoleus aerophilus) ha solo una bassa specificità per l’ospite. Colpisce principalmente volpi e ricci, ma anche cani, gatti e altre specie animali. Inoltre, C. aerophila ha anche un potenziale zoonotico.
Ciclo di sviluppo
I seguenti vermi polmonari hanno un ciclo vitale indiretto tramite ospiti intermedi:
- Cr. vulpis
- Ael. Astruso
- T. brevior
- A. vasorum
Per i primi tre vale quanto segue: i vermi adulti si trovano, a seconda del tipo di verme polmonare, nella trachea, nei bronchi, nei bronchioli o negli alveoli. Da lì, le femmine rilasciano le uova nelle vie respiratorie, da cui si schiude il primo stadio larvale (L1). Le L1 vengono poi espulse con la tosse, ingerite ed espulse con le feci. Nell’ambiente infettano varie specie di lumache e chiocciole, nelle quali si sviluppano fino al terzo stadio larvale infettivo (L3). Questo sviluppo nell’ospite intermedio è assolutamente necessario. Gli ospiti vertebrati definitivi, a loro volta, si infettano ingerendo un ospite intermedio o di trasporto (ad esempio uccelli, piccoli mammiferi, piccoli anfibi o rettili) (Fig.1).
Diversamente da ciò, gli adulti di A. vasorum (nota anche come filaria francese) parassitano le arterie polmonari e il cuore destro. Le uova prodotte dalle femmine vengono trasportate al polmone dal sangue. Lì le L1 si schiudono e migrano negli alveoli. L’ulteriore sviluppo procede analogamente a quanto sopra descritto.
I seguenti parassiti hanno un ciclo vitale diretto (senza sviluppo nell’ospite intermedio):
- O. osleri
- F. hirthi
- probabilmente anche C. aerophila
I vermi adulti di O. osleri provocano la formazione di noduli macroscopicamente visibili nell’epitelio della mucosa tracheale e bronchiale. Da lì, le femmine rilasciano le uova, che contengono già una L1 infetta, nel lume della trachea. Gli adulti di F. hirthi vivono nel parenchima polmonare e la L1 infettiva risale con la tosse per il tratto respiratorio e viene escreta nelle feci dopo la deglutizione. La trasmissione avviene per via fecale-orale, solitamente orizzontalmente in giovane età. Sono comuni anche le autoinfezioni. I cani positivi a O. osleri e F. hirthi devono essere isolati e tutti i cani venuti a contatto devono essere trattati a causa dell’infettività diretta di L1 (Fig. 2).
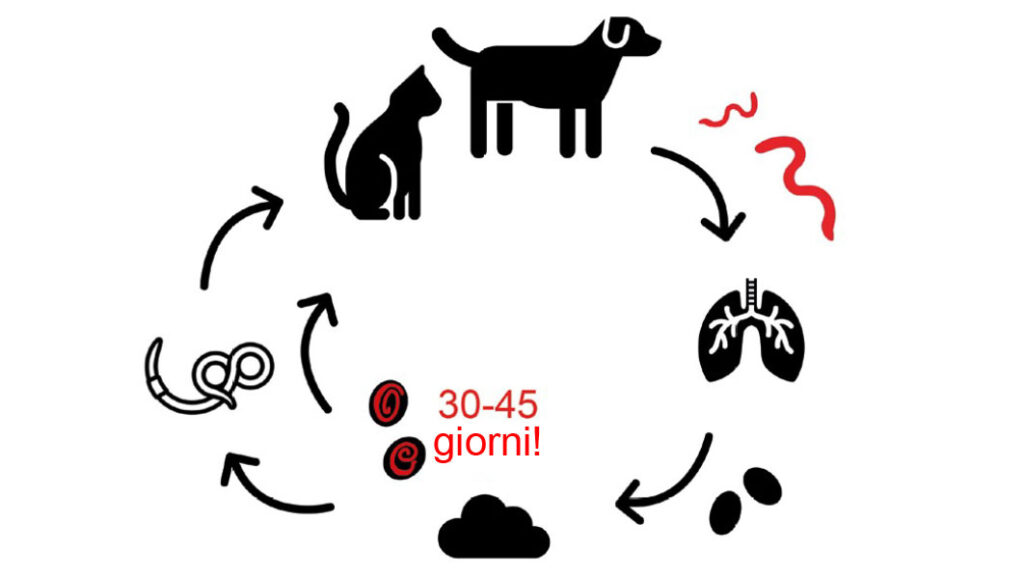
Gli stadi adulti di C. aerophila sono incorporati nella sottomucosa della trachea, dei bronchi e dei bronchioli. Qui depongono le uova, che poi con la tosse vengono ingoiate ed espulse con le feci. Nell’ambiente, queste uova diventano larve infettive dopo 30–45 giorni (uova embrionali). I lombrichi sono importanti nella trasmissione di C. aerophila, ma il loro ruolo (ospite intermedio o unico trasportatore) non è stato ancora definitivamente chiarito (Fig.3).
Per tutti i vermi polmonari citati vale quanto segue: gli ospiti definitivi (ad es. cani e gatti) si infettano attraverso l’ingestione orale di uno stadio infettivo, a seconda della specie di vermi polmonari, o attraverso l’ingestione di un ospite intermedio o di trasporto o per via oro-fecale. Dopo l’ingestione orale, le larve penetrano nella parete intestinale e raggiungono i polmoni per via linfatica e/o sanguigna oppure migrando attraverso le cavità corporee, dove maturano in adulti e divengono sessualmente maturi.
Sintomi clinici
I segni clinici dell’infezione sono molto variabili e derivano in ultima analisi da danni tissutali causati dagli stadi adulti o dalla migrazione delle larve. La gravità della malattia dipende quindi, tra le altre cose, dalla specie di vermi e dal carico presente. Gli animali giovani vengono colpiti più spesso e di solito si ammalano più gravemente a causa di un volume polmonare più piccolo e di un’immunità ancora in via di sviluppo.
Le infezioni da vermi polmonari possono essere asintomatiche; il rilevamento di larve di vermi polmonari o di uova di Capillaria è spesso un riscontro accidentale durante gli esami coproscopici di routine.
Ma sono anche possibili sintomi respiratori da lievi a gravi, tra cui: tosse, secrezione nasale, tachipnea, dispnea. Le infezioni da A. vasorum possono anche causare disturbi della coagulazione, versamenti pleurici e sintomi cardiovascolari e neurologici. Sono possibili esiti fatali.
- Immagine: dott.ssa Michaela Gentil
-
Fig. 1: Ciclo di vita dei vermi polmonari con ciclo di sviluppo indiretto,stadio infettivo contrassegnato con “!”
Immagine: Laboklin
-
Fig. 2: Ciclo di vita dei vermi polmonari con ciclo di sviluppo diretto, stadio infettivo contrassegnato con “!”
Immagine: Laboklin
-
Fig. 3: Ciclo vitale di Capillaria aerophila, stadio infettivo contrassegnato
con “!”
Immagine: Laboklin
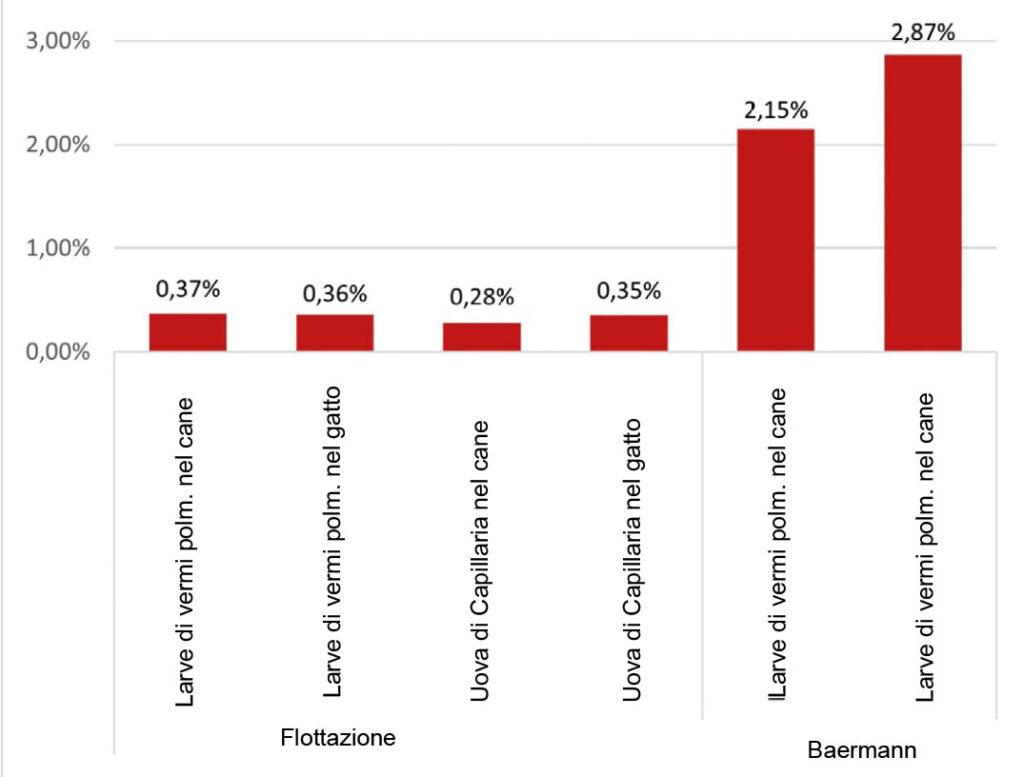
- Fig. 4: Frequenza di rilevamento di larve di vermi polmonari e uova di Capillaria utilizzando la flottazione (soluzione NaCl-glucosio [ρ = 1,3]) e il processo di Baermann-Wetzel nei cani (n = 97882 rispettiv. 5496) e nei gatti (n = 23869 rispettiv. 2160) in Germania nel 2021-2022.
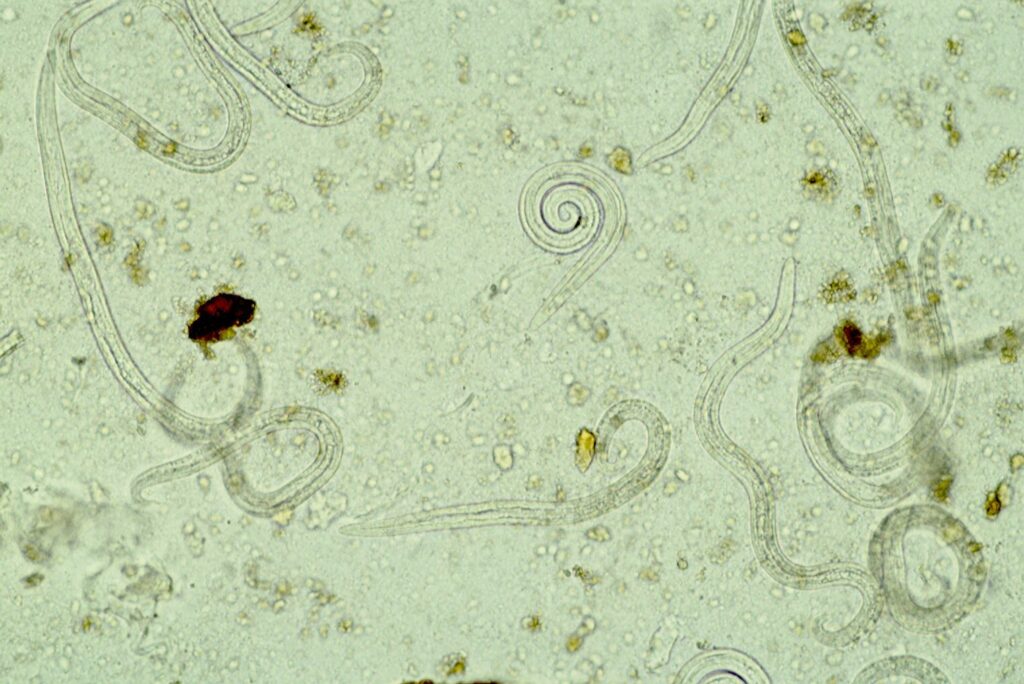
- Fig. 5: Larve di vermi polmonari nel processo di emigrazione Baermann-Wetzel, ingrandimento 20x
-
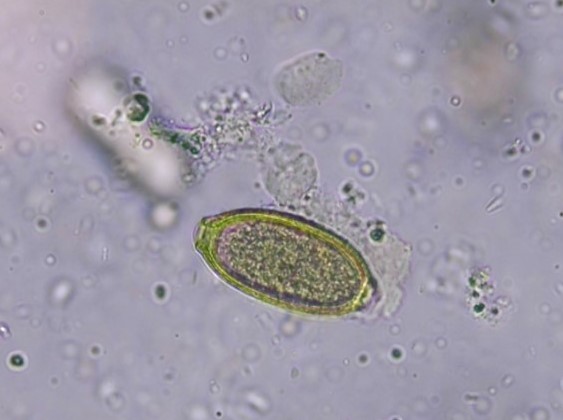
Fig. 6: uova di Capillaria, ingrandimento 40x
Immagine: Laboklin
Prevalenza
Le infezioni da vermi polmonari nei cani e nei gatti sono rare e questo si riflette anche nel nostro materiale di studio (Fig.4). Alcune rientrano tra le “malattie emergenti” (ad es. A. vasorum), alcune si verificano occasionalmente (ad es. C. aerophila), altre sono state descritte solo sporadicamente nell’Europa centrale (O. osleri, F. hirthi). Tuttavia, anche se rare, hanno rilevanza clinica perché possono portare a malattie gravi che possono essere fatali.
Diagnosi
Per fare una diagnosi è necessaria la prova della presenza di parassiti. Va notato che durante il periodo prepatenziale, cioè il tempo che intercorre tra l’infezione e la presenza di uova o larve diagnosticabili, non è possibile effettuare una diagnosi.
Coproscopia
Il rilevamento microscopico di larve o uova L1 nei campioni fecali è il metodo più comune: economico, non invasivo e aspecifico che rileva vari parassiti.
Anche se la sensibilità dei test è bassa a causa dell’escrezione intermittente di larve di vermi polmonari e uova di Capillaria, dovrebbe sempre essere il primo passo nella diagnosi. Per un risultato attendibile, l’esame dovrebbe essere effettuato da 3 campioni di feci di 3 giorni conscutivi. Se i risultati sono negativi, è consigliabile ripetere gli esami, soprattutto se esiste il sospetto clinico.
Striscio fecale diretto
L1 può essere facilmente rilevata nei campioni fecali freschi a causa della sua attività locomotoria. Per eseguire uno striscio fecale, una piccola quantità di feci fresche viene mescolata e distribuita su un vetrino da microscopio con un po’ d’acqua o soluzione salina e quindi esaminata al microscopio. Il metodo è economico e facile da eseguire, ma ha una sensibilità molto bassa a causa della piccola quantità di campione utilizzata e della mancanza di arricchimento.
Processo di flottazione
In questa procedura, un campione di feci delle dimensioni di un pisello viene sospeso in una soluzione (con zuccheri o sale) di peso specifico noto. Le particelle fecali affondano mentre il parassita più leggero si mette galleggerà sulla superficie e può essere trasferito su un vetrino da microscopio per essere eaminato. È il metodo di scelta per rilevare le uova di Capillaria, ma utilizzando questo metodo è possibile rilevare anche altre larve di vermi polmonari. La sensibilità del processo di flottazione è comunque limitata dalla quantità di campione che utilizzata.
Metodo dell’emigrazione larvale secondo Baermann-Wetzel
Un campione di feci delle dimensioni di una noce viene posto in un setaccio a maglie fini o in una garza fine e posto in un imbuto, all’estremità del quale è fissato un tubo flessibile che può essere chiuso con una fascetta. L’imbuto viene quindi riempito con acqua tiepida fino a coprire per metà il campione. Le larve vive sono attratte dall’umidità (idrotropismo), migrano attivamente dalle feci entro 12-24 ore e si depositano sul fondo del tubo. Le prime gocce provenienti dal tubo vengono posizionate su un vetrino per l’esame microscopico (Fig.5).
Questa procedura è considerata il gold standard per il rilevamento delle larve di vermi polmonari, ma presenta anche dei limiti: è una procedura relativamente complessa con un lungo periodo di esecuzione. Per la procedura sono necessari campioni fecali freschi, poiché solo le larve vive emigrano attivamente. Le L1 di O. osleri e F. hirthi sono letargiche e non migrano bene; pertanto, è più probabile che vengano rilevate utilizzando la flottazione.
Microscopia da altri materiali
Mentre le feci sono considerate il materiale migliore in molti casi, anche i tamponi tracheali o il liquido di lavaggio broncaalveolare (BAL) possono essere esaminati al microscopio per larve di vermi polmonari. Per alcuni come O. osleri e F. hirthi questi ultimi campioni sono più adatti rispetto ai campioni fecali.
Identificazione degli stadi dei vermi polmonari
Le uova di C. aerophila hanno un guscio esterno strutturato e misurano circa 60 – 70 x 35 – 40 μm, sono marroni, a forma di botte e hanno tappi polari asimmetrici (Fig.6). Vanno distinte dalle uova di Trichuris, più grandi, con guscio liscio, a forma di limone e con tappi polari sono simmetriche. Inoltre, nelle feci si possono rilevare anche uova di altre specie di Capillaria, sebbene siano morfologicamente molto simili. Pertanto, l’identificazione delle specie mediante esame microscopico non è sempre possibile.
Anche le larve L1 di differenti specie di vermi polmonari metastrongiloidi sono molto simili morfologicamente.
Pertanto la distinzione tra le diverse specie è difficile e richiede un attento esame morfometrico e morfologico. Con un’adeguata esperienza è possibile differenziare le specie morfologicamente guardando l’apertura boccale e la parte posteriore nonché la lunghezza.
Le larve dei nematodi polmonari devono essere differenziate anche dalle larve degli anchilostomi (nei campioni fecali più vecchi) e dai nematodi a vita libera o parassiti delle piante se il campione è stato raccolto dal terreno. Pertanto, un campione fecale per vermi polmonari deve essere il più fresco possibile.
Rilevazione PCR
Test PCR specifici sono disponibili per alcune specie di vermi polmonari in laboratori specializzati. In questo test, il DNA del parassita viene replicato e reso visibile. Utilizzando la PCR è possibile esaminare un’ampia varietà di campioni come feci, BAL, liquido di lavaggio tracheale, tamponi della gola profonda e tessuto polmonare. Il sangue in EDTA è adatto per rilevare A. vasorum. Sebbene la PCR sia generalmente un test molto sensibile, anche in questo caso la sensibilità è limitata dalle caratteristiche del parassita, p.es. Dalla sua escrezione intermittente delle larve.
Rilevazione dell’antigene
Per la rilevazione di A. vasorum sono disponibili test ELISA e test rapidi commerciali che rilevano gli antigeni circolanti del parassita nei campioni di siero.
Conclusione
Le infezioni da vermi polmonari dovrebbero sempre essere prese in considerazione nella diagnosi differenziale quando cani e gatti presentano una malattia cardiopolmonare. Tuttavia, a causa dell’escrezione intermittente e della sensibilità limitata di alcuni test, solo i risultati positivi indicano la presenza di un’infezione. Come campioni sono adatti soprattutto campioni fecali freschi.
Dott.ssa Michaela Gentil
L’offerta di Laboklin
- Esame parassitologico (flottazione/sedimentazione
- Test di Baermann-Wetzel
- PCR per Angiostrongylus vasorum, Crenosoma vulpis, Aelurostrongylus abstrusus e Troglostrongylus brevior
- Profili PCR per vermi polmonari per cane e gatto
- Ricerca antigeni per Angiostrongylus vasorum