I dermatofiti sono funghi filamentosi, cheratinofili, distribuiti in tutto il mondo. Infettano la pelle, i peli e le unghie e svolgono un ruolo importante a causa del loro potenziale zoonotico (de Matos e Kalivoda 2013). Secondo il National Center for Biotechnology Information (NCBI, Bethesda, Maryland, USA), sono attualmente divisi in 9 generi (tra cui Microsporum, Trichophyton e Arthroderma) (Schoch et al. 2020). Microsporum spp. e Trichophyton spp. sono le principali cause di dermatofitosi negli animali, soprattutto in cani e gatti (Paryuni et al. 2020). Nei piccoli mammiferi, soprattutto i funghi cutanei del complesso Trichophyton benhamiae (diverse specie antropofile e zoofile), prevalentemente Trichophyton (T.) benhamiae, raramente Microsporum (M.) canis o altre specie (Tab. 1) la cosiddetta tigna (Fréalle et al. 2007, ESCAPP 2021).
La denominazione corretta è difficile. Originariamente, T. benhamiae veniva classificato secondo criteri morfologici quali comportamento di crescita, fenotipo (giallo/bianco), aspetto microscopico e la forma di crescita anamorfica (asessuata) era inizialmente chiamata T. mentagrophytes (Fréalle et al. 2007). Il sequenziamento del DNA ha differenziato la principale forma teleomorfica (sessuale), risultando in una ridenominazione in Arthroderma (A.) benhamiae (Fréalle et al. 2007). Il nome attuale dal 2017 è complesso T. benhamiae (Hoog et al. 2017).
Nelle pubblicazioni più vecchie si trova il nome T. mentagrophytes, in quelle nuove T. benhamiae – ma entrambi si riferiscono alla stessa specie.
Chi ne viene colpito?
I porcellini d’India e i ricci sono più comunemente infettati dai dermatofiti, mentre altri piccoli mammiferi sono raramente infettati (Tab. 1).
La prevalenza di T. benhamiae nelle cavie varia a seconda del tipo di stabulazione. In uno studio su 59 cavie provenienti da 15 negozi di animali di Berlino, il 90% (53/59) è risultato positivo utilizzando la PCR (Kupsch et al. 2017). Nei Paesi Bassi, la prevalenza di T. mentagrophytes nei negozi di animali è stata del 16,8% (30/179) nelle cavie e del 3,8% (8/213) nei conigli (Overgaauw et al. 2017).
In un altro studio tedesco attuale sulle cavie, sono stati esaminati sia cavie da riproduzione che da compagnia (Berlino et al. 2020). Su un totale di 21 allevamenti privati, il 68,8% (262/381) degli animali è risultato positivo ai dermatofiti: di questi il 55,4% per T. benhamiae, il 13,4% per altri (7,1% T. interdigitale, 6,0 % T. rubrum, 2,6% T. erinacei, 2,3% T. verrucosum, 1,3% T. mentagrophytes). Il 92,7% di tutti gli animali erano portatori asintomatici. Non è stato possibile determinare le differenze dipendenti dal genere.
-
Fig. 1: Giovane porcellino d’India con tipica lesione crostosa sul dorso del naso in un caso di dermatofitosi
Immagine: Dott.ssa J.Hein
-
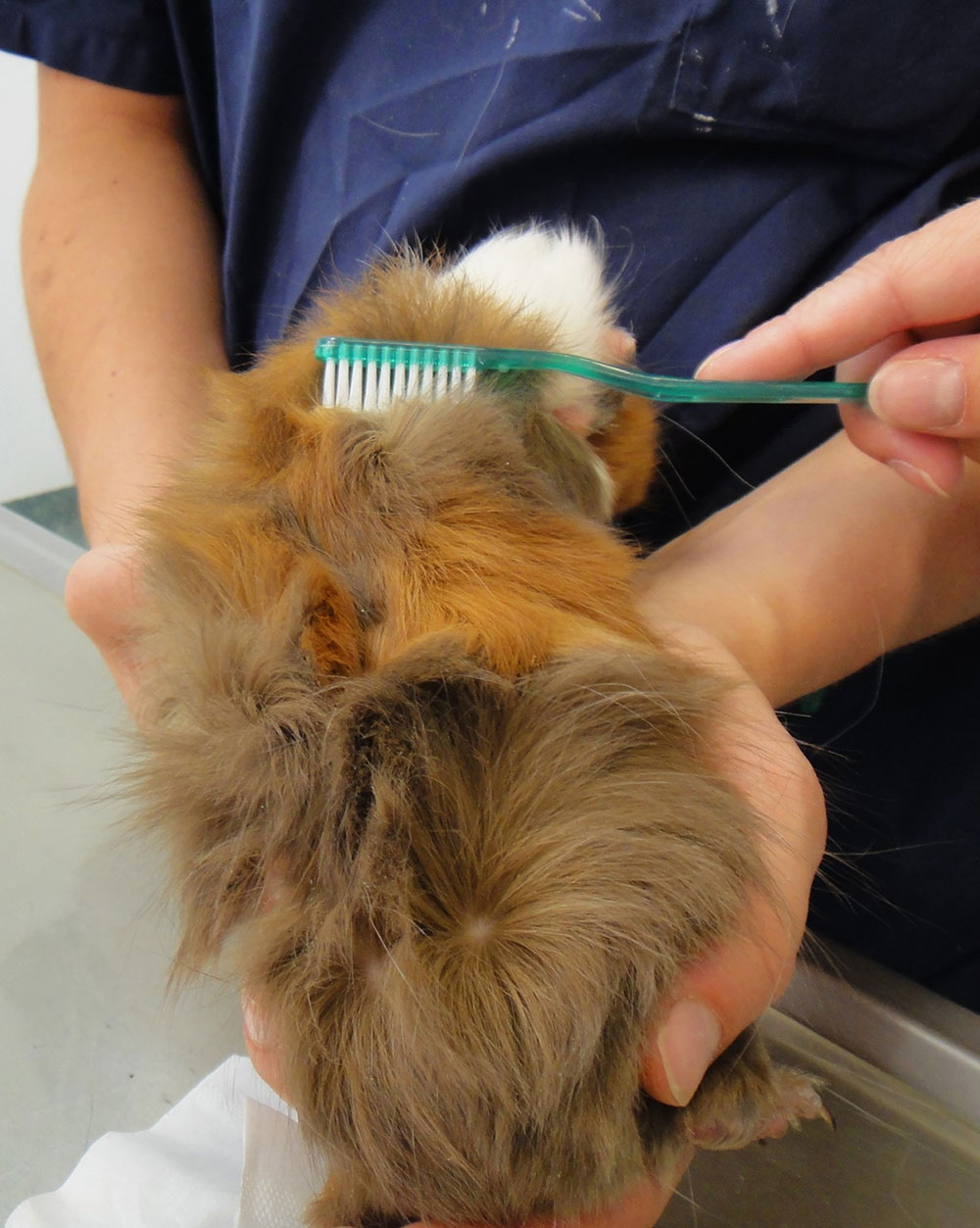
Fig. 2: Raccolta dei campioni per l’esame dei dermatofiti utilizzando lo spazzolino McKenzie
Immagine: dott.ssa J.Hein
Tab. 1: Presenza e frequenza dei dermatofiti nei piccoli mammiferi: **** frequente, ** raro, * molto raro; T.=Trichophyton, M.=Microsporum, N.=Nannizzia, A=Artroderma; vecchia denominazione a seconda del momento della pubblicazione.
Fonti: Berlin et al. 2020, de Matos e Kalivoda 2013, ESCCAP 2021, Kraemer et al. 2012, Overgaauw et al. 2017, Pignon e Mayer 2011, Vangeel et al. 2000
|
Specie |
Dermatofiti |
|||
| Porcellino d´India |
T. benhamiae (T. mentagrophytes)****, M. canis*, N. gypsea (M. gypseum)*, |
|||
|
Coniglio |
T. benhamiae (T. mentagrophytes)**, M. canis*, N. gypsea (M. gypseum)*, T. terrestre* |
|||
|
Furetto |
M. canis**, T. mentagrophytes** |
|||
|
Chinchilla |
T. mentagrophytes**, Microsporum spp.* | |||
|
Ratto |
T. mentagrophytes** (mainly asymptomatic carriers), Microsporum spp.* | |||
|
Topo |
T. mentagrophytes ** (mainly asymptomatic carriers) | |||
|
Gerbillo |
T. mentagrophytes **, N. gypsea (M. gypseum)* | |||
|
Circeto |
T. mentagrophytes**, Microsporum spp.* | |||
|
Riccio africano dal ventre bianco |
T. erinacei****, M. canis*, N. gypsea (M. gypseum)* | |||
Non è stato possibile determinarne le differenze. Le razze a pelo lungo con pelo riccio (74,0%) e le cavie Rex (68,1%) sono state colpite più spesso delle razze a pelo corto, gli animali tenuti in casa (67,2%) più spesso degli animali tenuti all’aperto. Allevamenti con variazioni più frequenti nel numero di animali (76,0%) erano significativamente più infetti da T. benhamiae rispetto agli animali di razze autosufficienti (37,1%) (Berlin et al. 2020).
Anche se è stato spesso descritto che i dermatofiti sono più frequenti negli animali giovani (de Matos e Kalivoda 2013, ESCCAP 2021, Kraemer et al. 2012), ciò non ha potuto essere confermato in questo studio condotto su cavie da allevamento (Berlin et al. 2020).
Valutando i 9.636 test di laboratorio su cavie da compagnia, la prevalenza di dermatofiti è stata del 3,9% (382/9.636) e negli animali con sospetto clinico è stata del 36,9% (382/1.035).
benhamiae è stato rilevato nel 98,2% degli animali con sospetto clinico (Berlin et al. 2020).
Un altro studio tedesco del 2012 ha esaminato anche la prevalenza di dermatofiti nelle cavie da compagnia inviate in laboratorio utilizzando l’esame colturale (Kraemer et al. 2012). I dermatofiti sono stati riscontrati nel 38,1% (431/1132) delle cavie da compagnia, di cui T. mentagrophytes nel 91,6% (395/431). Inoltre, sono state campionate cavie sane: l’8,5% (14/164) erano portatori asintomatici (Kraemer et al. 2012). La prevalenza nelle cavie da compagnia è quindi rimasta quasi la stessa.
Nella valutazione dei campioni di laboratorio del 2012, invece, i conigli da compagnia presentavano dermatofiti solo nell’8,1% (83/1021), di cui il 72,3% (60/83) aveva T. mentagrophytes.
Nella valutazione dei campioni di laboratorio del 2012, invece, i conigli da compagnia presentavano dermatofiti solo nell’8,1% (83/1021), di cui il 72,3% (60/83) aveva T. mentagrophytes. In questo studio non sono stati riscontrati portatori asintomatici nei conigli sani (0/140) (Kraemer et al. 2012). In uno studio belga il 3,8% (4/104) dei conigli da compagnia, da riproduzione e da laboratorio erano portatori asintomatici (Vangeel et al. 2000). Nello studio tedesco, i conigli con una coltura fungina positiva erano più giovani degli animali con una coltura fungina negativa o degli animali sani (Kraemer et al. 2012).
Nei ricci le dermatofitosi sono spesso causate da T. erinacei e molto raramente da M. canis e Nannizzia (N.) gypsea (M. gypseum) (Pignon e Mayer 2011). Negli animali clinicamente anormali, T. erinacei è stato diagnosticato in 4 animali su 5. Animali portatori asintomatici sono stati descritti nell’11,5% dei casi (47/408) (Pignon e Mayer 2011).
I dermatofiti sono comuni nelle cavie e rari nei conigli. Cavie provenienti dai negozi di animali (fino al 90%) e dagli allevamenti privati (68,8%) sono significativamente più colpiti rispetto alle cavie da compagnia (fino al 38,1%). La prevalenza nelle cavie asintomatiche varia tra il 3,9% (animali domestici) e il 92,7% a seconda dell’allevamento (ceppi riproduttivi).
Chi li trasmette?
Le dermatofitosi sono zoonosi! È stata spesso descritta la trasmissione all’uomo. Durante la pandemia del coronavirus, il numero di infezioni umane da T. benhamiae è aumentato in linea con il crescente numero di piccoli animali tenuti in quel periodo (Uhrlaß et al. 2023). Erano colpiti soprattutto i bambini e i giovani, a causa del contatto spesso ravvicinato con animali domestici. Un’infezione può essere pericolosa per le persone immunocompromesse (National Research Platform for Zoonoses 2020).
La fonte più comune di infezioni umane sono le cavie (Berlin et al. 2020, Kupsch et al. 2017, National Research Platform for Zoonoses 2020, Nenoff et al. 2014, Uhrlaß et al. 2023).
Ma anche i conigli possono diventare potenziali fonti di pericolo. Nel 27,3% (3/11) delle famiglie colpite, con conigli da compagnia dermatofiti positivi, erano infetti per lo più i bambini (Krämer et al. 2012). La trasmissione dei dermatofiti avviene anche dai ricci europei e dai ricci dal ventre bianco africani all’uomo (Pignon e Mayer 2011, Riley e Chomel 2005).
La trasmissione dei dermatofiti avviene direttamente e indirettamente attraverso oggetti contaminati da spore, lettiera, spazzole e pettini (de Matos e Kalivoda 2013, ESCCAP 2021). I furetti infetti spesso vivono con i gatti (de Matos e Kalivoda 2013). Probabilmente i ricci si infettano attraverso il contatto diretto con la madre o la madre o per i comportamenti di combattimento e corteggiamento, poiché le alterazioni spesso si verificano sulla testa (Pignon e Mayer 2011). Un numero elevato di animali in uno spazio ristretto aumenta la pressione dell’infezione (Berlin et al. 2020, de Matos e Kalivoda 2013).
Le manifestazioni cliniche si verificano spesso con immunosoppressione causata da stress, altre malattie di base, infestazioni parassitarie, svezzamento negli animali giovani e climi caldi e umidi.
Lesioni, screpolature della pelle e aumento dell’umidità cutanea favoriscono l’infezione (Berlin et al. 2020).
I sintomi clinici tipici sono alopecia areata, pelo spezzato, forfora, eritema, croste gialle e talvolta prurito (de Matos e Kalivoda 2013). Inizialmente, le dermatofitosi iniziano spesso sulla testa (dorso del naso, palpebre e padiglioni auricolari) (fig. 1). La piodermite secondaria si verifica spesso e si diffonde alle zampe (anteriori), al letto degli artigli e successivamente a tutto il corpo (de Matos e Kalivoda 2013). Lesioni squamose e non pruriginose si verificano spesso soprattutto nei ricci principalmente sulla testa, con perdita degli aghi (de Matos e Kalivoda 2013, Pignon e Mayer 2011).
Come fare diagnosi?
I campioni per la diagnostica micologica vengono prelevati meglio utilizzando la tecnica della spazzola McKenzie (fig. 2). Per aumentare la sensibilità, viene spazzolato per 1-2 minuti l’intero animale e non solo le aree cutanee modificate, con uno spazzolino sterile (spazzolino da denti, citobrush) (Berlin e Gräser 2020). Inoltre, dovrebbero venire prelevati alcuni peli con le loro radici nei punti di passaggio tra le aree cutanee colpite, conservandoli in un contenitore o in un sacchetto richiudibile. L’esame microscopico (ad esempio il tricogramma) può essere utilizzato per rilevare ife o spore fungine su e/o nei peli. Tuttavia, un risultato negativo non esclude l’infezione. Con l’aiuto della lampada di Wood è possibile rilevare solo un’infezione da M. canis. Tuttavia, la fluorescenza appare solo nel 50% circa delle infezioni. Si verifica la fluorescenza dai metaboliti immagazzinati nei follicoli piliferi che si formano durante un’infezione e possono normalmente essere rilevati 7 – 14 giorni dopo l’infezione (Moriello et al. 2017). Risultati falsi positivi possono ad es. essere causati da lanugine, farmaci topici o addirittura da residui di sapone (Moriello et al. 2017).
Il rilevamento mediante coltura micologica viene effettuato mediante coltivazione su terreni di coltura speciali con successiva differenziazione macroscopica e microscopica. Per evitare una crescita eccessiva di muffe è opportuno pulire il pelo con un panno inumidito con alcool prima di prelevare un campione. Inoltre, in laboratorio vengono utilizzati terreni di coltura selettivi per sopprimere la crescita di contaminanti. La durata della coltura micologica varia. Spesso si possono ottenere risultati positivi entro 1 settimana. In caso negativo, la coltura viene solitamente incubata per 3-4 settimane per escluderne la crescita.
Il laboratorio nazionale di consulenza per i dermatofiti consiglia il rilevamento mediante PCR a causa del tempo di analisi più rapido di soli 2 – 3 giorni. È possibile la differenziazione della specie. Poiché la PCR rileva anche le spore morte, il controllo della terapia mediante PCR può essere effettuato solo dopo che le spore sono state completamente rimosse con la balneoterapia e dovrebbe essere presa in considerazione nell’interpretazione dei risultati. Pertanto, si raccomanda l’uso di colture fungine per monitorare la terapia (ESCCAP 2009). Anche l’esame istologico di una biopsia cutanea mediante colorazioni speciali fornisce risultati entro pochi giorni. Tuttavia è conclusiva solo in casi positivi, è invasiva e quindi non è uno strumento diagnostico di scelta (Weider 2015).
La procedura più sensibile dipende dalla clinica, dalla raccolta dei campioni e dallo studio. Studi più recenti hanno mostrato un’elevata sensibilità della microscopia seguita dalla PCR in caso di lesioni ermatofitiche visibili (Gnat et al. 2022). Negli animali asintomatici, la PCR è solitamente superiore (Berlino e Gräser 2020, Nikaein et al. 2023). Tuttavia, la letteratura specialistica più recente raccomanda di combinare PCR e coltura per un risultato affidabile (Frost et al. 2022).
Terapia
Il trattamento delle dermatofitosi deve essere effettuato secondo le attuali raccomandazioni ESCCAP (combinazione di terapia sistemica [itraconazolo] e balneoterapia [enilconazolo due volte a settimana]) (Berlino e Gräser 2020, ESCCAP 2009, Hein 2016, Körnig 2021). La soluzione del bagno non viene sciacquata. Per proteggerli dall’ipotermia, gli animali devono essere avvolti in un asciugamano dopo i trattamenti di lavaggio. Il trattamento locale delle sole aree cutanee colpite dovrebbe essere rigorosamente rifiutato a causa dell’elevato rischio di zoonosi, che si manifesta anche in animali asintomatici (Berlin e Gräser 2020, ESCCAP 2009, Hein 2016, Körnig 2021).
Devono essere trattati tutti gli animali dell’allevamento, indipendentemente dal quadro clinico! La terapia idealmente termina dopo 2 controlli negativi. Un trattamento ambientale (gabbia, casette, utensili per la toelettatura, indumenti, ecc.) è assolutamente necessario in parallelo ai trattamenti balneari. Oggetti della gabbia difficili da disinfettare devono essere sostituiti con scatole di cartone ecc. per tutta la durata della terapia.
I test, prima di introdurre nuovi animali nell’allevamento, sono particolarmente indicati dato che che spesso le cavie presentano un’infezione subclinica (ESCCAP 2009).
Conclusione
I dermatofiti possono essere presenti in quasi tutti i piccoli mammiferi, ma sono comuni solo nelle cavie e nei ricci. Poiché le cavie asintomatiche sono i principali vettori per l’infezione dell’uomo, soprattutto dei bambini, dovrebbero venire testate al momento del loro acquisto. L’autoprotezione è importante e non deve essere trascurata.
Dott.sse Jana Liebscher, Jutta Hein