L’animale è castrato o non castrato? Questa domanda sorge sempre quando ci si presentano animali ritrovati o nei rifugi per animali abbiamo soggetti senza cicatrici da castrazione e quindi lo stato di castrazione è poco chiaro. Oppure abbiamo animali più vecchi, presumibilmente castrati, che mostrano nuovamente comportamenti sessuali tipici come cavalcare, sgroppare, inseguire e una maggiore aggressività.
Ci sono varie possibili cause:
- l’animale non è castrato
- l’animale è castrato in modo incompleto (sindrome del residuo ovarico – ORS, criptorchidismo o tessuto testicolare residuo)
- l’animale è castrato, ma ha un tumore che produce ormoni sessuali, ad nelle ghiandole surrenali (iperadrenocorticismo).
-
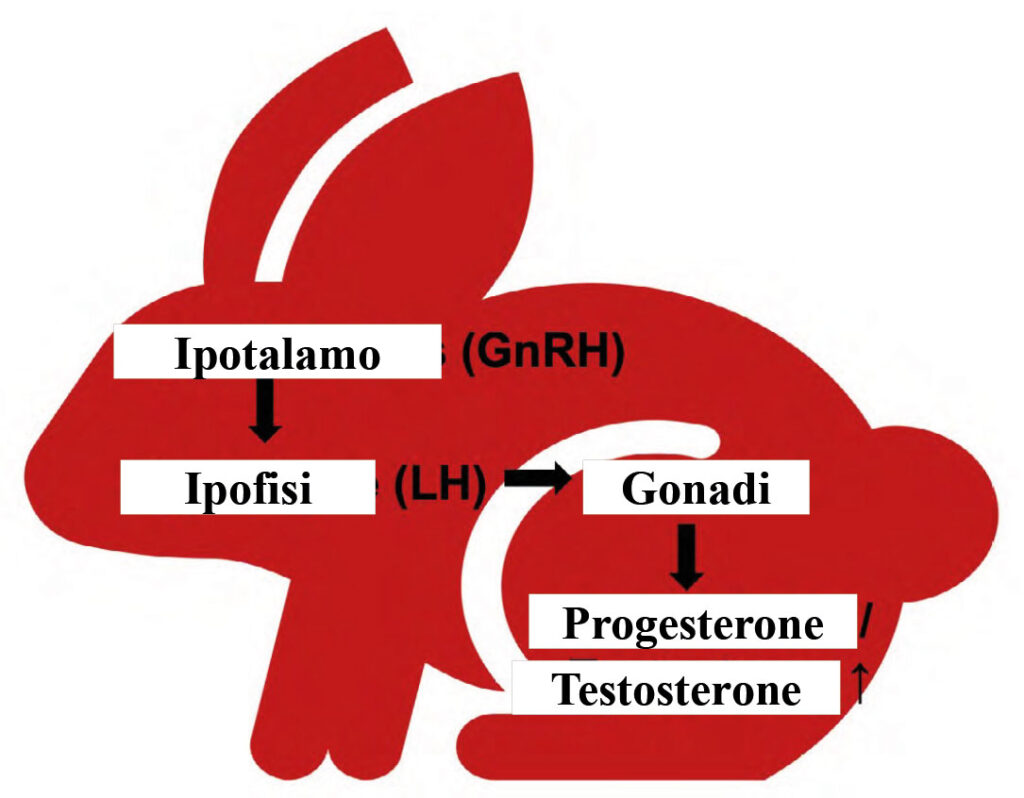
Fig. 1: Rappresentazione schematica dell’asse ipotalamo-ipofisi – ovaio/testicolo
Immagine: J. Liebscher
Ciò che conta sono i passi successivi: la prevenzione delle neoplasie genitali-specifiche (tumori dell’ovaio, dell’utero, dei testicoli) e la loro diagnosi nonché l’eventuale terapia delle neoplasie esistenti.
In che modo aiuta la diagnostica di laboratorio?
Ogni esame di laboratorio è preceduto da una dettagliata anamnesi e da un approfondito esame clinico. Se non viene trovata alcuna prova chiara dello stato di castrazione, sarà utile un esame del sangue.
In linea di principio esistono tre diverse opzioni, più o meno adatte a seconda della specie e dell’età dell’animale.
- Determinazioni del valore basale delle concentrazioni degli ormoni sessuali classici (testosterone, estradiolo, progesterone, 17-OH-progesterone, altri ormoni steroidei supplementari)
- Test di stimolazione dell’HCG (con 2 misurazioni della concentrazione di progesterone o testosterone)
- novità per i conigli: determinazione della concentrazione dell’ormone anti mülleriano (AMH)
I vantaggi e gli svantaggi dei singoli test per i diversi piccoli mammiferi sono discussi qui di seguito.
1. Determinazioni del valore basale delle concentrazioni degli ormoni sessuali classici
In linea di principio la determinazione dei singoli ormoni sessuali è possibile anche nei piccoli mammiferi, ma solo per alcune specie animali sono disponibili valori di riferimento affidabili. In genere, la concentrazione di progesterone viene misurata nelle femmine e la concentrazione di testosterone nei maschi.
Tuttavia, le determinazioni dei valori basali sono determinanti per quanto riguarda lo stato di castrazione solo se le concentrazioni ormonali sono elevate.
Valori individuali bassi (valori basali) non sono diagnosticamente conclusivi:
- gli animali possono essere castrati
- le femmine possono essere in anestro
- la produzione di ormoni è attualmente al minimo ciclico.
La concentrazione di estradiolo è soggetta a forti fluttuazioni e quindi non è adatta per rispondere alla domanda “castrazione sì/no”. Tuttavia, può essere utilizzato per la diagnosi in animali maschi con sospetto tumore alle cellule di Sertoli produttrici di estrogeni o in furetti castrati con sospetto iperadrenocorticismo. Gli androgeni e il 17-OH-progesterone svolgono un ruolo solo nella diagnosi dell’iperadrenocorticismo nei furetti castrati e possono essere richiesti con l’apposito pacchetto (profilo NNR furetto).
2. Test di stimolazione con HCG (con 2 misurazioni di progesterone o testosterone)
Per individuare chiaramente il tessuto gonadico è utile un test di stimolazione con HCG, con misurazione della concentrazione di progesterone nelle femmine o di testosterone nei maschi.
Il GnRH stimola la secrezione di LH dalla ghiandola pituitaria anteriore. L’LH, a sua volta, stimola la produzione di progesterone nelle ovaie e di testosterone nelle cellule di Leydig (Fig.1).
I preparati di Buserelin (analogo del GnRH, Receptal®, Buserelin®, Veterelin®) sono attualmente approvati per i piccoli mammiferi – e qui solo per i conigli. Tuttavia, studi in vitro hanno dimostrato che Buserelin riduce la produzione di progesterone nella fase luteale media e tardiva (Zerani et al. 2010) e quindi può portare a risultati falsamente bassi. Pertanto i preparati con HCG (Ovogest®, Suigonan®) vengono utilizzati più frequentemente. Non sono approvati per nessun piccolo mammifero e devono essere riutilizzati di conseguenza, ma sono stati provati e testati molte volte e possono essere utilizzati con successo (situazione attuale in Germania).
L’esecuzione e l’interpretazione del test di stimolazione nei conigli sono descritte nella tabella 1. In letteratura non sono ancora stati descritti test specifici per altri piccoli mammiferi, ma la corrispondenza è molto probabile.
Determinazione della concentrazione dell’ormone antimulleriano (AMH) nei conigli
Una buona alternativa al test di stimolazione con HCG nei conigli è la determinazione della concentrazione dell’AMH. Nei cani e nei gatti, l’AMH viene ora utilizzato di routine per distinguere tra castrati/non castrati e per diagnosticare ORS o criptorchidismo. L’AMH è adatto anche per la diagnosi dei tumori delle cellule della granulosa nelle cavalle, cagne e vacche e per la diagnosi di tumori a cellule del Sertoli nei cani maschi. Nei cavalli, l’AMH viene sempre utilizzato per la diagnostica di criptorchidismo (Böhmer 2023).
Tab. 1 – Test di stimolazione con HCG per la diagnosi del tessuto gonadico nei conigli (basato su Geyer 2015, Schützenhofer 2011)
| Maschio | Femmina | |
| Esecuzione: | ||
| 1. Prelievo (valore basale): | misurazione del testosterone | misurazione del progesterone |
| Iniezione di: | 0,8 μg Buserelin (p.es. Receptal®) oppure 100- 250 IU/animale HCG (p.es. Ovogest®) i. m. | |
| 2. Prelievo (valore di stimolazione): | prelievo dopo 1 ora | prelievo dopo 5-7 giorni |
| Interpretazione del valore di stimolazione: | testosterone | progesterone |
| presente tessuto produttore di ormoni (non castrato, ORS) | > 1 ng/ml | > 4 ng/ml |
| valore dubbio | 0,1 – 1 ng/ml | 2 – 4 ng/ml |
| nessun tessuto che produce ormoni (castrato) | < 0,1 ng/ml | < 2 ng/ml |
L’AMH è una glicoproteina coinvolta nella differenziazione sessuale del feto. Negli animali maschi porta alla soppressione dello sviluppo dei dotti mulleriani. Allo stesso tempo, l’epididimo, i vasi deferenti e le ghiandole delle vescicole seminali si differenziano sotto l’influenza del testosterone dai dotti di Wolff. Nella femmina questa inibizione da parte dell’AMH non avviene e i dotti mulleriani si sviluppano poi nelle tube di Falloppio, nell’utero, nella cervice e nella vagina craniale. Negli animali sessualmente maturi l’AMH è prodotto esclusivamente nelle cellule della granulosa delle ovaie e nelle cellule del Sertoli dei testicoli, indipendentemente dal ciclo (Böhmer 2023).
Nuove pubblicazioni mostrano che i test utilizzati per determinare le concentrazioni di AMH in altre specie animali sono adatti anche per misurare le concentrazioni nei conigli (Böhmer et al. 2022).
Böhmer e colleghi (2022) hanno collaborato con Laboklin per esaminare le concentrazioni di AMH mediante un test di chemiluminescenza (CLIA) in 64 coniglie femmine adulte intere e 22 castrate per determinare la distinzione castrate/non castrate, nonché la concentrazione di AMH in relazione a false gravidanze e numero dei follicoli (Böhmer et al. 2022). Per determinare se sussisteva una falsa gravidanza, è stata misurata anche la concentrazione di progesterone (< 2 ng/ml: fase follicolare, non falsa gravidanza, > 2 ng/ml: fase luteinica, falsa gravidanza). Tutti le femmine castrate mostravano concentrazioni di AMH < 0,07 ng/ml, differivano in modo altamente significativo (p < 0,001) da quelle delle coniglie intere e gli intervalli di valori non si sovrapponevano (Tab.2). Non è stata riscontrata alcuna differenza significativa nelle fasi follicolare e luteinica (p <0,951).
Nell’ambito di ulteriori studi interni a Laboklin (2023), dati simili sono stati misurati su 33 conigli maschi castrati utilizzando lo stesso macchinario e test CLIA (Tab.2). Per il coniglio maschio castrato è stato stabilito un intervallo di riferimento preliminare di <0,07 ng/ml.
Tab. 2 – Concentrazioni di AMH nei conigli (CLIA; animali femmine, secondo Böhmer et al. 2022; animali maschi, dati non pubblicati da Laboklin)
| Stato di castrazione |
Quantità | Media ± deviazione standard (ng/ml) | Mediana (ng/ml) | Range (ng/ml) |
| femmina castrata |
22 | 0,05 ± 0,04 | 0,06 | 0,01 – 0,23 |
| femmina intera |
64 | 1,67 ± 0,64 | 1,53 | 0,77 – 3,36 |
|
femmina: AMH < 0,07 ng/ml → castrata |
||||
| maschio castrato |
33 | 0,04 ± 0,03 | 0,03 | 0,01 – 0,12 |
| maschio intero |
11 | 14,00 ± 7,83 | 12,94 | 3,76 – 22,96 |
|
maschio: AMH < 0,07 ng/ml → castrato |
||||
I risultati sono coerenti con quelli di altri studi (Schwarze 2023), in cui sono stati utilizzati dispositivi e procedure di test diversi.
Le differenze tra maschi interi e criptorchidi non sono state ancora studiate. Nei cani, nei vitelli e negli stalloni, i soggetti criptorchidi hanno concentrazioni di AMH più elevate rispetto a quelli interi a causa delle cellule immature del Sertoli e/o della mancanza di soppressione da parte del testosterone (Böhmer 2023).
Pertanto, la determinazione dell’AMH sia nei conigli maschi che nelle femmine, è particolarmente adatta per verificare lo stato di castrazione. Il vantaggio è che il sangue viene prelevato una volta senza iniezione e i risultati sono disponibili rapidamente. Lo svantaggio è la sensibilità del campione, che richiede l’invio di siero refrigerato, centrifugato e pipettato (almeno 200 μl).
Concentrazioni di AMH superiori a 0,07 ng/ml sono indicative di tessuto gonadico.
Sono necessari ulteriori studi sull’applicabilità delle misurazioni dell’AMH in altri piccoli mammiferi e nel contesto della diagnostica dei tumori ORS e delle cellule della granulosa/cellule del Sertoli, nonché nell’area dell’iperadrenocorticismo nei piccoli mammiferi.
Conclusioni
Il gold standard per distinguere tra piccoli mammiferi castrati e non castrati è il test di stimolazione con HCG con 2 misurazioni di progesterone / testosterone. Le misurazioni individuali sono determinanti solo per gli animali non castrati con alte concentrazioni. Nei conigli, il test dell’AMH è una buona alternativa.
Jana Liebscher, dott.ssa Jutta Hein
Test a tua disposizione presso Laboklin
- Testosterone
- Progesterone
- Test di stimolazione con HCG
- Ormone anti Mulleriano (coniglio)