Fisiologia e compiti del microbiota intestinale
Il microbiota gastrointestinale è una complessa comunità di microrganismi che colonizzano il tratto digestivo e svolgono un ruolo importante nella salute e nel benessere degli animali. È costituito per il 99% da specie batteriche anaerobiche che crescono in assenza di ossigeno atmosferico e appartengono, ad esempio, ai ceppi batterici Firmicutes, Proteobacteria e Fusobacteriota.
Tuttavia, l’esatta composizione del microbiota intestinale varia da individuo a individuo, cambia nel corso della vita ed è fortemente influenzata da fattori quali dieta, malattie, farmaci e condizioni ambientali.
Un microbiota intestinale sano supporta la digestione, le difese immunitarie, la produzione di vitamine e acidi grassi a catena corta (SCFA) e la difesa contro i germi patogeni. A tal fine, i singoli ceppi batterici sono strettamente correlati, interagiscono tra loro in un processo noto come alimentazione incrociata formando il proprio ecosistema altamente interconnesso.
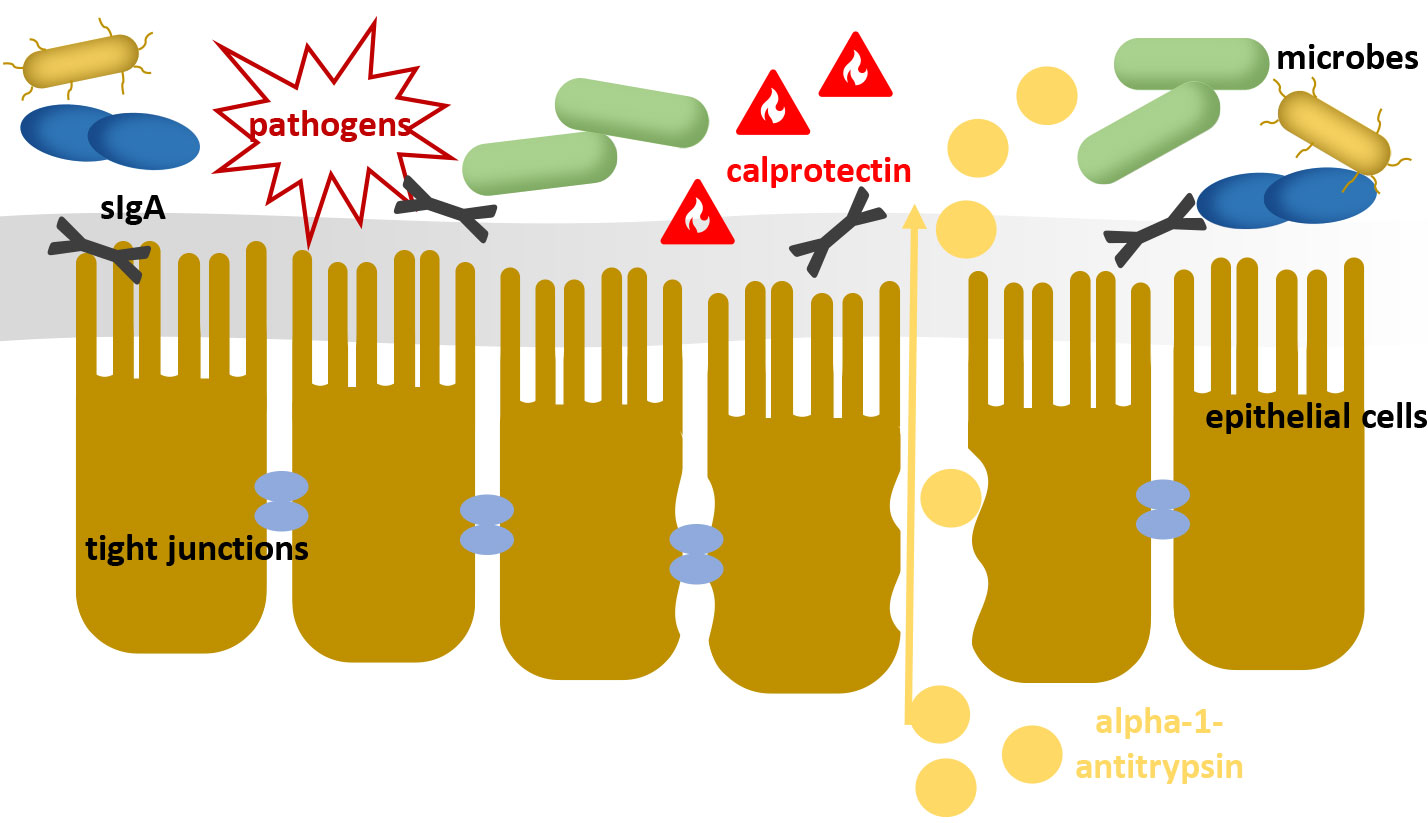
Questo ecosistema del microbiota intestinale può essere visto come il primo livello della barriera intestinale. Con la sua sola presenza e le sue prestazioni metaboliche impedisce la colonizzazione di agenti patogeni e ne ostacola la proliferazione (resistenza alla colonizzazione).
Il successivo strato di muco e la mucosa intestinale continuano a fornire una barriera meccanica contro germi e antigeni estranei.
Le cellule epiteliali intestinali sono collegate tra loro da “giunzioni strette” (connessioni cellula-cellula), in modo che il trasferimento di sostanze avvenga in modo molto selettivo dove la mucosa è intatta.
Come terzo livello della barriera intestinale, un ruolo importante è svolto dal tessuto linfoide associato all’intestino (GALT).
Il semplice esistere del microbiota intestinale contribuisce al mantenimento di una barriera immunologica difensiva contro i germi estranei attraverso il costante allenamento del GALT. Inoltre, i patogeni vengono respinti attivamente stimolando la sintesi di peptidi antimicrobici come le ß-defensine e le immunoglobuline. La diminuzione della funzione di barriera, ad esempio a causa di squilibri batterici, può portare, tra le altre cose, al trasferimento di antigeni, endotossine, metaboliti centralmente attivi dal lume intestinale nel flusso sanguigno che avvia o perfeziona diversi meccanismi patogenetici.
Conseguenze e diagnosi della disbiosi
La disbiosi del microbiota è un disturbo nell’equilibrio tra le diverse specie batteriche che può portare a una diminuzione della diversità, a un aumento del numero di batteri potenzialmente dannosi e alterazione della funzione del microbiota. Può essere innescato o facilitato da vari fattori, come stress, cambiamenti nella dieta, terapia antibiotica, infezioni o malattie intestinali croniche. Inoltre, in presenza di sintomi gastrointestinali preesistenti, la disbiosi può portare ad un rapido peggioramento dei sintomi clinici.
Un’analisi della disbiosi, ad es. mediante PCR quantitativa (campione: feci) può quindi essere un utile strumento diagnostico per valutare l’entità della disfunzione intestinale e per consentire una terapia mirata. I sintomi clinici che giustificano l’analisi della disbiosi includono, ma non sono limitati, a:
- infiammazioni croniche e acute intestinali
- flatulenza, diarrea, costipazione
- sindrome da crescita eccessiva dell’intestino tenue (SIBO), sindrome dell’intestino irritabile
- maldigestione, malassorbimento, carenze di micronutrienti
- intolleranze alimentari, allergie
- prurito, eczema
- perdita del pelo
-
Fig. 1: Una barriera intestinale danneggiata perde la sua funzione protettiva contro agenti patogeni e inquinanti
Immagine: Laboklin
-
Fig. 2: Leila cane femmina (sinistra) e feci (destra)
Immagine: dott.ssa Jennifer Scherzer
-
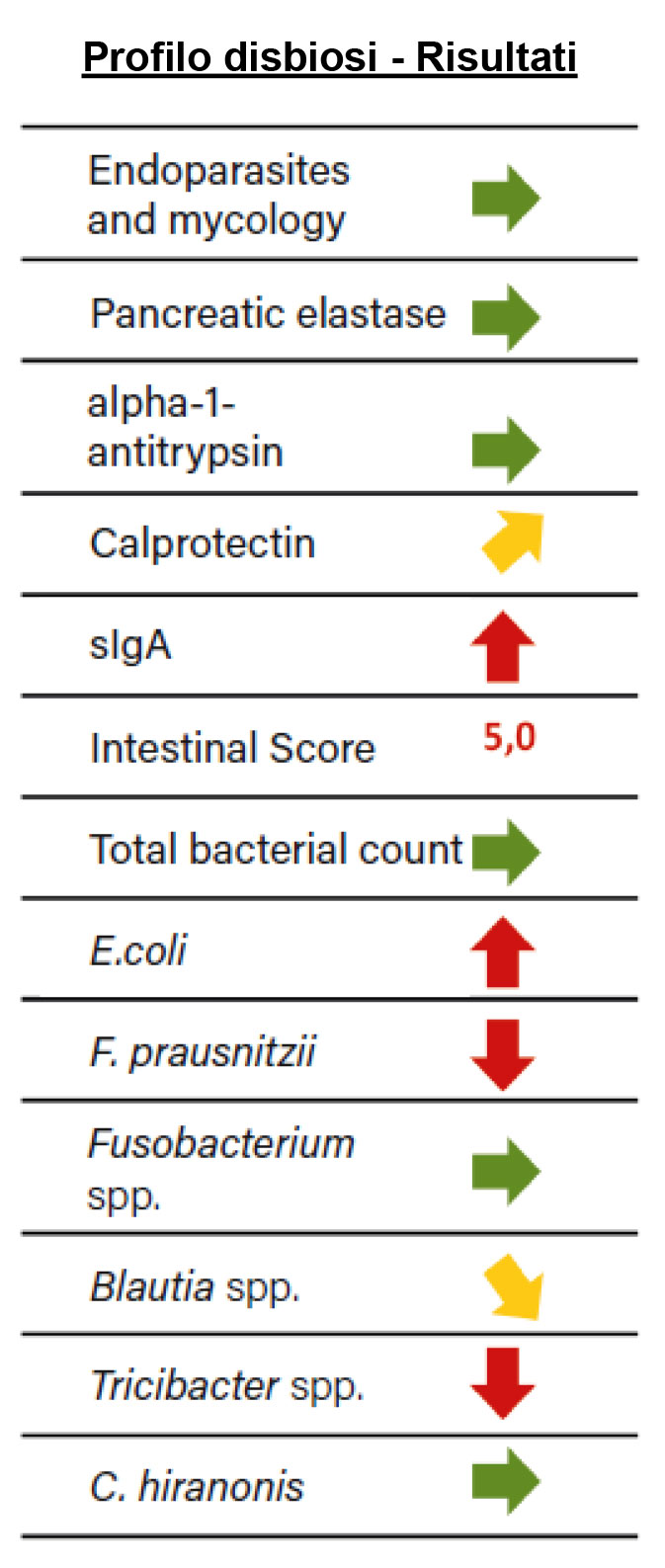
Fig. 3: Risultato del profilo di disbiosi della cagnolina “Leila”. Le frecce verdi corrispondono ai valori di riferimento o non mostrano alcuna anomalia rispetto ai valori di riferimento. Le frecce gialle indicano un leggero aumento o diminuzione e le frecce rosse indicano una forte deviazione.
Immagine: Laboklin
Poiché i modelli di malattia e i sintomi clinici non possono necessariamente essere ricondotti a un singolo ceppo o specie batterica, la diagnostica si concentra sulla misurazione di interi gruppi batterici funzionali.
Dagli studi sono stati individuati, nel cane e nel gatto, alcuni batteri e gruppi batterici che possono essere utilizzati come batteri marcatori per uno stato disbiotico dell’intestino.
Il rilevamento dei batteri marcatori mediante metodi biologici molecolari può fornire informazioni sulla resistenza alla colonizzazione. D’altra parte, l’osservazione di singoli gruppi batterici funzionali, come i batteri che formano SCFA o che proteggono la mucosa, può consentire di trarre conclusioni sulla condizione dello strato di muco e sull’apporto energetico delle cellule epiteliali intestinali.
Tuttavia, va notato che le cause della disbiosi possono essere molto diverse e il disturbo dell’equilibrio batterico ha un’influenza diretta sulla funzione di barriera della parete intestinale. Pertanto, la determinazione di ulteriori parametri può essere utile per esaminare più in dettaglio la condizione della barriera intestinale (Fig. 1).
Biomarcatori fecali per la valutazione della mucosa intestinale e delle performance digestive
Oltre ai batteri marcatori, i seguenti parametri biochimici possono integrare il profilo della disbiosi:
- calprotectina – è adatto come un marcatore infiammatorio nella diagnostica differenziale per una serie di malattie del tratto gastrointestinale (ad es. IBD o altre malattie infiammatorie intestinali). Allo stesso modo, può essere utilizzata per monitorare il corso della terapia e rilevare le recidive di queste malattie.
- alfa-1-antitripsina – può essere utilizzata come marcatore della perdita di proteine attraverso l’intestino. Tuttavia, va notato che questo non è un marcatore specifico per l’intestino infiammato. Livelli elevati si verificano in altri malattie gastrointestinali o sistemiche che comportano un aumento della permeabilità intestinale (“leaky gut”).
- la concentrazione di elastasi pancreatica canina 1 – riflette direttamente la funzione pancreatica esocrina. Una carenza di elastasi pancreatica può portare a problemi digestivi e malnutrizione. Un basso valore nelle feci indica una mancanza di produzione dell’enzima digestivo. La diminuzione dell’efficienza digestiva prececale porta anche ad un aumento dell’afflusso di grassi e proteine nel colon. Ciò sposta l’ambiente a favore di germi potenzialmente dannosi e può favorire lo sviluppo della disbiosi.
Un altro biomarcatore, l’IgA secretoria (sIgA), può fornire informazioni sul carico sulla mucosa intestinale ed è nuovamente offerta nel profilo della disbiosi per cani e gatti dal 01.07.2023.
Significato e funzione delle sIgA
L’anticorpo sIgA, che si trova principalmente sulle membrane mucose, funge da prima linea di difesa contro gli agenti patogeni che possono penetrare attraverso il tratto respiratorio, il tratto gastrointestinale o la pelle. Come componente importante del GALT, si lega a microbi o antigeni potenzialmente dannosi, impedendo loro di attraccare o danneggiare la parete intestinale.
La relazione tra microbioma intestinale e sIgA non è ancora del tutto chiarita, ma il microbiota ha un impatto sul GALT e quindi sulla formazione e funzione delle sIgA. Da un lato, promuove la maturazione e l’attivazione delle plasmacellule che producono sIgA. D’altra parte, sIgA modula la composizione e l’attività del microbiota intestinale legandosi selettivamente o inibendo determinati microbi. Questo crea una relazione simbiotica importante per il mantenimento della barriera intestinale e dell’immunità della mucosa.
sIgA è un importante marker diagnostico per varie malattie del tratto gastrointestinale, come l’enteropatia infiammatoria cronica o la sindrome dell’intestino permeabile. La determinazione delle sIgA nelle feci può fornire informazioni sulla capacità funzionale e sul sistema immunitario associato all’intestino.
- Una ridotta rilevazione di sIgA può indicare una compromissione della barriera intestinale e un indebolimento del sistema immunitario locale. Ciò può essere associato ad una maggiore suscettibilità alle malattie intestinali, maggiore suscettibilità alle infezioni, reazioni allergiche o condizioni immunosoppressive.
- Un livello elevato di sIgA può indicare un particolare sforzo del sistema immunitario intestinale, che può essere causato da un’infiammazione acuta o cronica della mucosa intestinale. Le possibili condizioni includono colite, IBD o parassitosi.
La determinazione delle sIgA nelle feci è un metodo semplice e non invasivo per valutare lo stato immunitario locale nell’intestino. Tuttavia, dovrebbe sempre essere interpretata in combinazione con altri parametri clinici e di laboratorio per fare una diagnosi corretta.
Caso studio
Leila è una Boxer di 8 anni che ha sofferto di diarrea ricorrente (Fig. 2), flatulenza e perdita di appetito per diversi mesi.
È stato eseguito un profilo di disbiosi dalle feci (Fig. 3). L’analisi ha rivelato livelli elevati di sIgA e calprotectina. Ciò indica un’infiammazione della mucosa intestinale e un forte stress del sistema immunitario locale.
L’analisi dei germi marcatori ha rivelato una ridotta diversità del microbioma. Il punteggio intestinale di 5.0 era nel range anormale, indicando uno stato disbiotico.
Uno sguardo più attento ai gruppi di batteri marcatori ha rivelato una riduzione da lieve a forte dei valori di riferimento di F. prausnitzii, Turicibacter spp. e Blautia spp.
Queste specie appartengono al phylum Firmicutes e svolgono un ruolo cruciale nell’approvvigionamento energetico delle cellule del tratto intestinale come produttori di SCFA o riciclatori di SCFA.
Proteobacterium E. coli, d’altra parte, era elevato rispetto al range di riferimento. Questo viene osservato nei cani in relazione a disturbi gastrointestinali. Oltre allo spostamento dei batteri protettivi della mucosa, il forte effetto immunogenico e i metaboliti avversi possono contribuire all’irritazione della mucosa intestinale. Inoltre, l’ambiente intestinale viene così spostato a favore dei patogeni.
Passando a un mangime facilmente digeribile con l’aggiunta di prebiotici, è possibile promuovere la crescita dei batteri protettivi della mucosa inibendo la diffusione di batteri dannosi. Questo effetto può essere ulteriormente potenziato dall’uso aggiuntivo di probiotici. Di conseguenza, gli enterociti sono di nuovo riforniti di energia e diminuiscono le conseguenze dell’irritazione da parte dei metaboliti batterici nocivi.
Se necessario, la terapia può essere integrata con l’aggiunta di farmaci antinfiammatori.
Dott.ssa Jennifer Scherzer