Nella medicina dei piccoli animali già da molti anni la citologia si è affermata come metodica di routine. Fino ad ora questa metodica è stata utilizzata molto raramente nei rettili. Ai medici veterinari che si occupano di rettili vengono presentati molti pazienti con problemi dermatologici. In questi casi mediante la citologia possiamo limitare di molto le diagnosi differenziali o ci è di iniziare il trattamento subito dopo la diagnosi. Questo è un gran vantaggio in quanto molti pazienti arrivano con una sintomatologia in stato avanzato e necessitano quindi di un intervento rapido e preciso.
La citologia è una tipica “metodica istantanea”, è possibile cioè avere un esito immedia-tamente dopo il prelievo. Anche con l’invio del campione al laboratorio il risultato viene emesso un giorno prima rispetto a quello di un esame istologico in quanto non è necessaria alcuna ulteriore lavorazione del campione. Lo sforzo tecnico è basso, le soluzioni per la colorazione sono a basso costo e possono venire conservate facilmente.
La citologia si occupa della diagnostica cellulare a partire da strisci colorati. Il suo obiettivo è quello di raggiungere un aumento delle diagnosi cliniche velocemente, senza grandi sforzi tecnici così come senza anestesia e con procedure minimamente invasive. Importante per la valutazione dei preparati e l’interpretazione degli esiti è una precisa anamnesi. Sono analizzabili tutti i materiali che tecnicamente possono poi essere strisciati su vetrino. Per esempio: campioni provenienti dalla cute, dalla corazza, da gonfiori, secreti, escreti o essudati. La metodica per il prelievo dipende dalle condizioni come localizzazione, il rendimento / la quantità di materiale prevista e la consistenza.
Qui di seguito elenchiamo le diverse tecniche e le loro applicazioni.
L’obiettivo nell’allestimento dei campioni citologici è realizzare uno spessore del preparato costituito da un unico strato di cellule (monostrato). A tale scopo vengono usate sia la tecnica per l’allestimento dello striscio di sangue (con un vetrino coprioggetto posto a 45°) sia la tecnica dello strisciamento. Per fare ciò si pone un vetrino copri-oggetto sopra al materiale aspirato e si attende fino a che il materiale aspirato non si distribuisce tra i due vetrini; quindi i due vetrini vengono strisciati senza pressione allontanandoli in direzioni opposte. I preparati vengono poi asciugati all’aria prima della colorazione.
Prelievo e allestimento dei preparati
1. Aspirazione con ago sottile
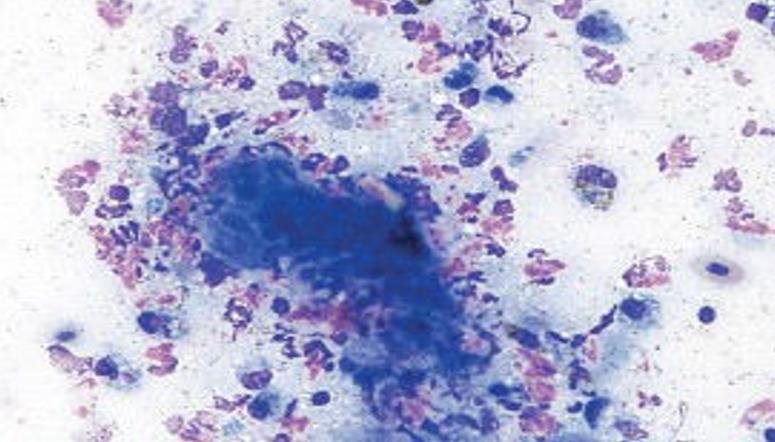
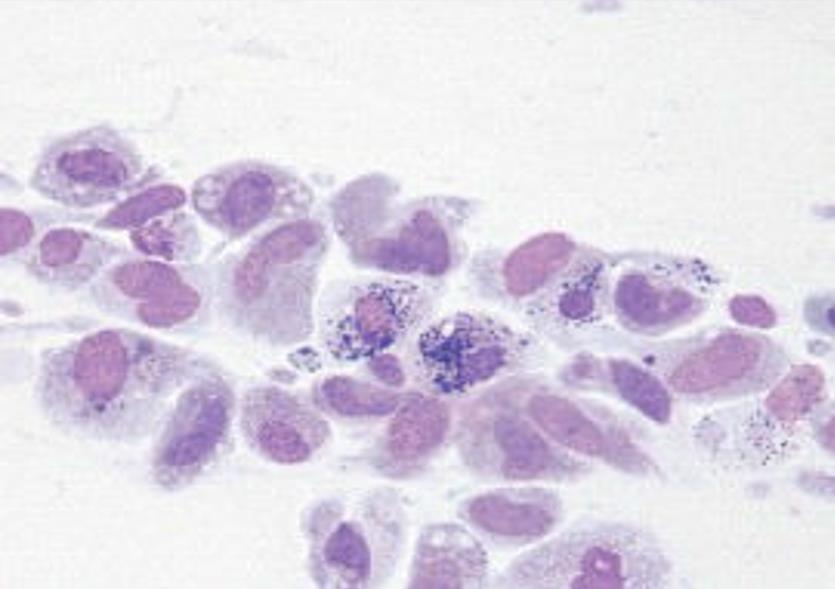
Questa tecnica è uno dei metodi più comunemente usati. Prevalentemente vengono esaminati gonfiori e lesioni cutanee. Dato che con questa tecnica è possibile prele- vare molto materiale cellulare, questa tecnica si adatta alla differenziazione di infiammazioni (soprattutto granulomi e ascessi, frequenti nei rettili) (fig. 1) e di neoplasie (fig. 2).
Si utilizzano aghi di 20 G fino a 25 G e siringhe da 2-5 ml. Si applica il seguente principio: tanto più morbido è il campione da aspirare, tanto più fine sarà l’ago da usare.
Si inserisce l’ago nel campione e si preleva il materiale con o senza aspirazione. Nel caso di aspirazione con ago sottile, l’ago viene inserito in diverse direzioni e il materiale viene prelevato attraverso il “taglio” dato dalla resistenza dei tessuti. Il contenuto dell’ago viene posto accuratamente sulla parte centrale di uno o più vetrini. Lo striscio dovrebbe seguire immediatamente dopo il prelievo in modo da evitare autolisi o coagulazione del campione nell’ago stesso.
2. Aspirazione di materiale liquido
Per il campionamento di raccolte di liquido cutanee come per esempio nella Blister Disease (formazione di vescicole cutanee) dei serpenti (tecnopatia provocata da un ambiente troppo umido), in presenza di edemi sottocutanei dati da insufficienza circolatoria o di gonfiori articolari come nella gotta articolare (fig. 3) si usano solitamente aghi di 18 G e siringhe da 2-5 ml. Se il liquido aspirato risulta torbido, può venire usata la normale tecnica usata per lo striscio di sangue su vetrino. L’allestimento dei vetrini con materiale proveniente dai puntati dovrebbe comunque essere eseguito direttamente dopo il prelievo. La conservazione cellulare durante il trasporto è molto sensibile a autolisi e colonizzazione microbica. Se il liquido è chiaro dovrebbe venire centrifugato (5 minuti a 1500 – 3000 giri/min) e con il sedimento formatosi si dovrebbe procedere alla preparazione del/dei vetrino/i.
Se si decide di inviare il liquido prelevato per la citologia e per eventuali esami chimico-clinici, questo dovrebbe essere inserito in una provetta con EDTA o litio-eparina. La quantità minima per l’invio di puntati al laboratorio è di 1 ml. Con questo volume possono essere eseguite tutte le indagini principali.
3. Preparati per apposizione
I preparati per apposizione sono allestiti principalmente a partire da lesioni cutanee. Nel caso di cute asciutta o alterazioni della corazza questo prelievo risulta spesso difficile dato che il materiale da prelevare risulta non rilevante con questa tecnica. Generalmente il il vetrino viene appoggiato delicatamente ma con una buona pressione sulla superficie del tessuto da analizzare. Quando si tratta di identificare un patogeno superficiale, non può essere effettuata alcuna pulizia della zona. Per la rilevazione di patogeni in profondità, può essere invece utile un curettage della zona sede del prelievo. Solo così saremo in condizione di rilevare dalle lesioni germi come micobatteri o funghi. Nel caso di un sospetto di tumore in una zona ulcerata, si deve procedere con un lavaggio tramite ringer o soluzione salina per poter ottenere una esposizione delle cellule. Lesioni molto umide/sanguinanti devono venire tamponate delicatamente per essere asciugate e per avere quindi accesso alle cellule significative. I preparati per apposizione possono venire allestiti anche da campioni di tessuto escissi. È necessario eseguire una superficie di taglio fresca e assorbire il liquido sulla superficie di taglio con carta assorbente. Le dimensioni dei campioni di tessuto non devono superare i 0,5 cm. La superficie di taglio va pressata, meglio se più volte, su un vetrino in modo da ottenere campioni spessi. Questa tecnica permette di differenziare infiammazioni e tumori, cosa spesso non possibile a livello macroscopico data la similitudine dei quadri che appaiono a livello visivo. Questo è valido soprattutto per ii granulomi confluenti.
- Fig. 1a: Camaleonte pantera femmina, rigonfiamento ulcerato della coda
- Fig. 1b: ago aspirato, infiammazione piogranulomatosa in assegna di reperti di patogeni intralesionali (colorazione Pappenheim, 500x)
- Fig. 2a: Pogona, aumento delle dimensioni della palpebra destra
- Fig. 2b: Agoaspirato, cellule fusiformi fino a polimorfe con granuli neri nel citoplasma, melanofori (colorazione di Pappenheim, 500x)
- Fig. 3a: Anolide, con anoressia, gonfiore delle articolazioni degli arti
- Fig. 3b: Aspirato con ago sottile, urati altamente aghiformi, gotta delle articolazioni (400x, non colorato)
- Fig. 4a: Tartaruga di terra con perdita degli artigli e lesioni cutanee umide
- Fig. 4b: Preparato per apposizione: batteri altamente bastoncellari, nessun elemento fungino (colorazione di Pappenheim, 500x)
4. Tamponi / Cytobrush
Questa metodica per la raccolta dei campioni viene usata ad esempio in caso di lesioni cutanee e campioni congiuntivali. Il tampone di cotone sterile viene inumidito prima del campionamento con soluzione salina sterile. Il materiale viene depositato facendo ruotare il tampone sul vetrino. Una alternativa al tampone sono dei piccoli spazzolini (cytobrush). Questa tecnica nei rettili può venire utilizzata per esempio per differenziare la flora superficiale, per lo più secondaria, dai germi significativi presenti nella profondità delle lesioni. In questo senso esistono anche colorazioni speciali per l’identificazione dei funghi, come la reazione PAS o la colorazione col blu lattofenolo, così come per i batteri acido resistenti si utilizza la colorazione Ziehl-Nielsen, dato che questi patogeni sono di grande importanza nei rettili.
5. Colorazione
I preparati, asciugati all’aria, vengono colorati in ambulatorio o in laboratorio con una colorazione ematologica modificata secondo Romanowsky (p.es. Wright, MayGrünwald, DiffQuick). Anche nel caso di preparati già allestiti per propria indagine si può procedere con l’invio degli stessi al laboratorio.
Prima della colorazione devono essere considerati diversi fattori.
In nessun caso i preparati vanno asciugati con un phon o con una fiamma dato che il calore può portare alla distruzione delle cellule. Anche altri tipi di fissazione (alcool) dovrebbero essere evitate. La spedizione di campioni citologici e istologici dovrebbe avvenire separatamente in quanto la formalina può influenzare la colorazione e la morfologia cellulare.
Anamnesi
L’anamnesi è importante e in molti casi decisiva per l’interpretazione degli esiti degli esami citologici. Questa dovrebbe essere indicata insieme a specie, sesso, età del paziente ed a informazioni su eventuali esami già effettuati, sulla distribuzione clinica, sulla localizzazione e sulla durata così come sulla natura del campionamento. Molto utili sono anche eventuali fotografie delle regioni alterate e una lista di diagnosi differenziali. Così il quadro clinico è completo, le diagnosi differenziali possono venire discusse e aumenta la pertinenza del referto.
(Per le immagini macroscopiche fornite ringraziamo la clinica delle dott.sse Birgit Rüschoff e Bettina Christian di Amburgo)