La valutazione delle malattie respiratorie degli equini si basa sull’anamnesi, sull’esame clinico, sui reperti endoscopici e sui test di funzionalità polmonare; inoltre, gli esami di laboratorio, come la citologia del materiale campionato dalle vie respiratorie (TBS – secrezione tracheobronchiale e BAL – lavaggio broncoalveolare), sono anch’essi elementi importanti nel processo diagnostico. Come sempre, il valore dei test di laboratorio rimane invariato con la selezione del materiale adatto e la sua preparazione ottimale.
L’esame TBS e/o BAL è indicato per i classici segni delle malattie delle vie respiratorie come tosse, suoni respiratori patologici, secrezione nasale e dispnea. Tuttavia, anche l’intolleranza all’esercizio è una delle indicazioni poiché i segni clinici possono essere molto sottili, specialmente nell’asma equina da lieve a moderata (precedentemente: Malattia infiammatoria delle vie aeree (IAD)).
La raccolta di TBS e BAL è stata recentemente descritta in dettaglio da Schwarz e Kühn con utili suggerimenti per l’applicazione pratica.
Ma quando è preferibile esaminare il TBS e quando è meglio il BAL? Qual è il significato dei risultati ottenuti dai diversi materiali raccolti? Idealmente, si dovrebbero prelevare entrambi i campioni. Per gli esami batteriologici è preferibile il materiale tracheale, quindi se si sospettano malattie batteriche (es. febbre) si dovrebbe sempre prendere il TBS. Il BAL è controindicato nella sospetta polmonite batterica. Tuttavia, il BAL è molto più adatto per l’esame citologico perché i suoi risultati si correlano meglio con la fisiopatologia rispetto a quelli di TBS. Inoltre, poiché il quadro citologico del TBS non è rappresentativo delle vie aeree più profonde, il BAL è il metodo di scelta per lo studio citologico delle malattie polmonari diffuse.
La corretta preparazione del campione è fondamentale per una diagnosi di successo tanto quanto la raccolta del campione. Sfortunatamente, le cellule degenerano molto rapidamente nei liquidi di lavaggio. Pertanto, anche se i campioni vengono inviati a un laboratorio per la valutazione, la preparazione citologica deve essere eseguita immediatamente dal campione di materiale appena ottenuto. Se gli strisci vengono effettuati solo in laboratorio, le cellule spesso non possono più essere valutate dopo solo poche ore di trasporto / conservazione e il significato dei risultati citologici diminuisce rapidamente.
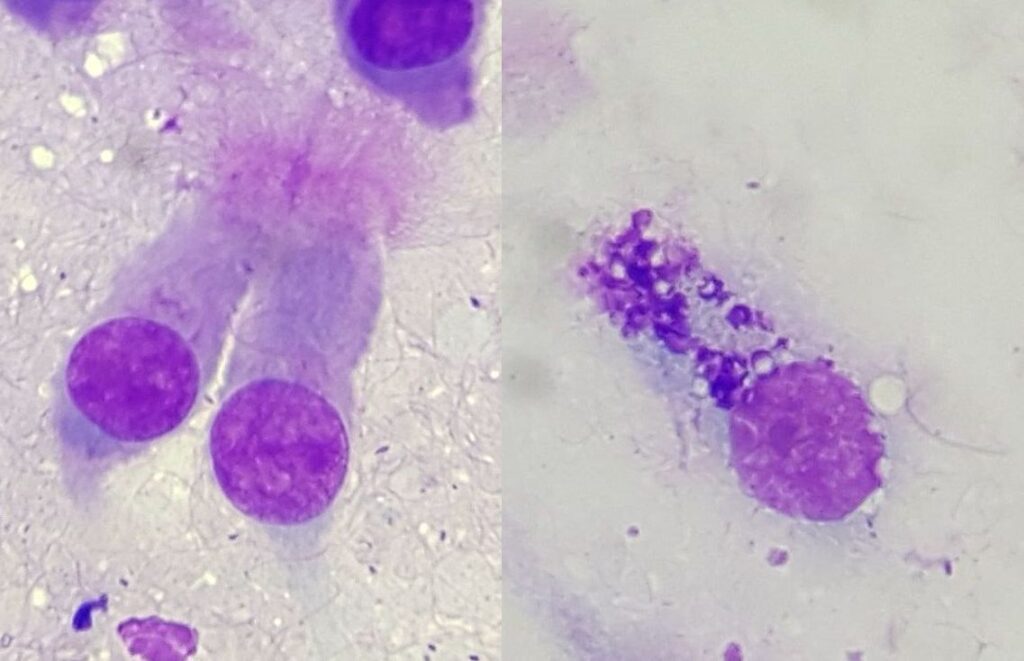
Se il TBS può essere ottenuto senza lavaggio, gli strisci vengono preparati direttamente dal muco. A tale scopo, una goccia di campione viene posta su un vetrino da microscopio, un secondo vetrino viene posizionato sopra di esso senza pressione e trascinato rapidamente sopra il primo, oppure entrambi i vetrini vengono distanziati in direzioni opposte in modo da distribuire il materiale del campione sul vetrino “come il burro su una pagnotta” (Fig. 1). Se il TBS è stato ottenuto mediante lavaggio, il materiale viene prima centrifugato a bassa velocità (200–300 g), poi il liquido viene decantato e infine si deposita una goccia di muco sedimentato come descritto sopra.
Il BAL è sempre povero di cellule, quindi è necessario effettuare preparativi di arricchimento per la valutazione citologica. Il metodo più semplice consiste nell’eseguire strisci di sedimenti: una parte del campione viene centrifugata a bassa velocità, analogamente ai campioni di lavaggio tracheale e il surnatante viene ampiamente decantato. Il pellet cellulare viene risospeso con il resto del liquido e distribuito utilizzando la tecnica dello striscio di sangue. Una leggera goccia di sospensione viene posta su un’estremità di un vetrino. Un secondo vetrino viene posizionato davanti alla goccia con un angolo di circa 45° e lo si sposta verso la goccia fino a quando il liquido non diffonde su tutto il bordo. Infine, si distribuisce il campione sul vetrino spingendo il vetrino in avanti vigorosamente e in modo uniforme. I preparati di altissima qualità per la valutazione dei fluidi poveri di cellule sono prodotti dalla citocentrifugazione. Per alcune centrifughe sono disponibili inserti speciali per questo scopo, ma vale la pena acquistarli solo se usati frequentemente. Tuttavia, è anche possibile costruire una “camera di sedimentazione” fatta in casa (Fig. 2): una siringa da 2 ml viene premuta saldamente su un vetrino, coperto da una carta da filtro con un foro della stessa dimensione proprio all’apertura della siringa, con robusti morsetti. Il materiale del campione viene versato attraverso il cono della siringa. La carta da filtro assorbe lentamente il liquido, arricchendo il campione di cellule nell’area del foro del vetrino. Per evitare la moltiplicazione in vitro dei batteri, la camera deve essere conservata in frigorifero durante la sedimentazione.
È fondamentale asciugare i preparati il più rapidamente possibile per preservare le cellule. Soprattutto con materiale viscoso, il processo di essiccazione può essere accelerato ponendo gli strisci in un’incubatrice o su una superficie calda. È anche possibile un’attenta asciugatura con aria tiepida. Per la spedizione a un laboratorio, i vetrini asciutti e non colorati sono imballati in scatole di spedizione, aliquote rappresentative dei campioni raccolti sono racchiuse in provette ermeticamente sigillate e non rivestite. Il materiale del campione liquido deve raggiungere il laboratorio il più rapidamente possibile e refrigerato (possibilmente aggiungere un siberino).
Le preparazioni possono essere colorate con coloranti rapidi commerciali tipo Romanowsky, ma almeno uno striscio deve essere colorato con un colorante specifico per i granuli dei mastociti, come il blu di toluidina.
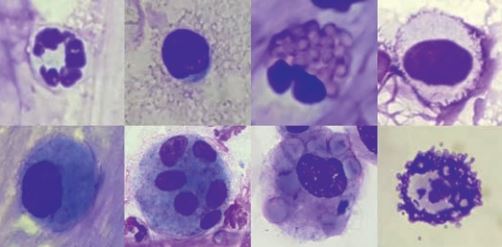
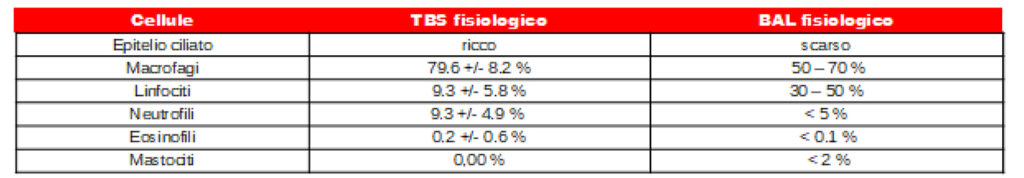
Questi granuli sono facilmente rilevabili nei campioni delle vie respiratorie, sebbene siano diagnosticamente molto significativi (Fig. 4). Il pattern cellulare fisiologico di TBS e BAL riflette la struttura anatomica delle rispettive sezioni del tratto respiratorio. Negli animali sani, gli strisci citologici sono poveri di cellule, con poche cellule tissutali (epitelio ciliato e cellule caliciformi, fig. 3) e un piccolo numero di cellule infiammatorie (principalmente macrofagi e linfociti, meno neutrofili, eosinofili e mastociti, fig. 4). Una panoramica della composizione cellulare di TBS e BAL nei cavalli asintomatici è mostrata nella tabella 1.
- Immagine: dott.ssa Maria Christian
-
Fig. 1: Tecnica di compressione
Immagine: Laboklin
-
Fig. 2: Una camera di sedimentazione costituita da un vetrino, una carta da filtro perforata, una siringa e 2 robuste pinze.
Immagine: Laboklin
-
Fig. 3: Colorazione rapida tipo Romanowsky. A sinistra: epitelio ciliato. A destra: una cella a calice.
Source: Laboklin
-
Fig. 4: Cellule infiammatorie; in alto da sinistra a destra: neutrofili, linfociti, eosinofili, mastociti (colorazione rapida Romanowsky); in basso da sinistra a destra: macrofago inattivato, macrofago multinucleato, eritrofagocitosi, mastociti (blu di toluidina).
Immagine: Laboklin
-
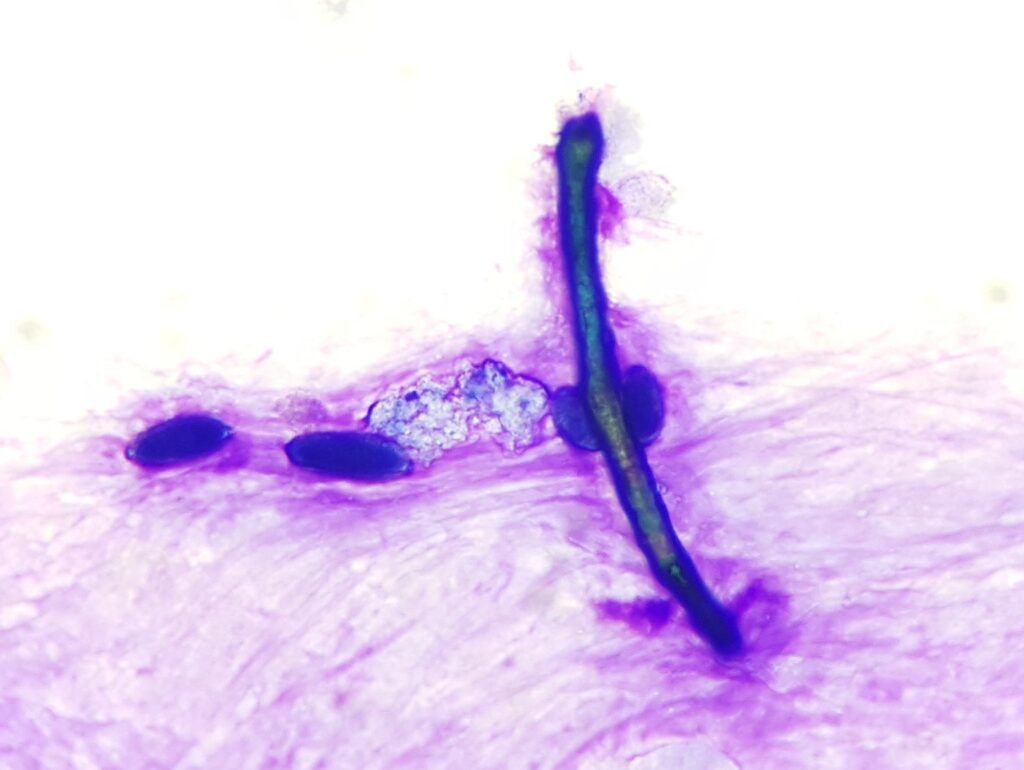
Fig. 5: Ifa fungina allungata a doppia parete e 4 granuli di polline. Colorazione rapida di tipo Romanowsky
Immagine: Laboklin
-
Tab. 1: composizione cellulare fisiologica di TBS e BAL
in accordo con Cian et al 2015
-
Tab. 2: composizione cellulare del BAL nell’asma equina
in accordo con Cian et al 2015
-
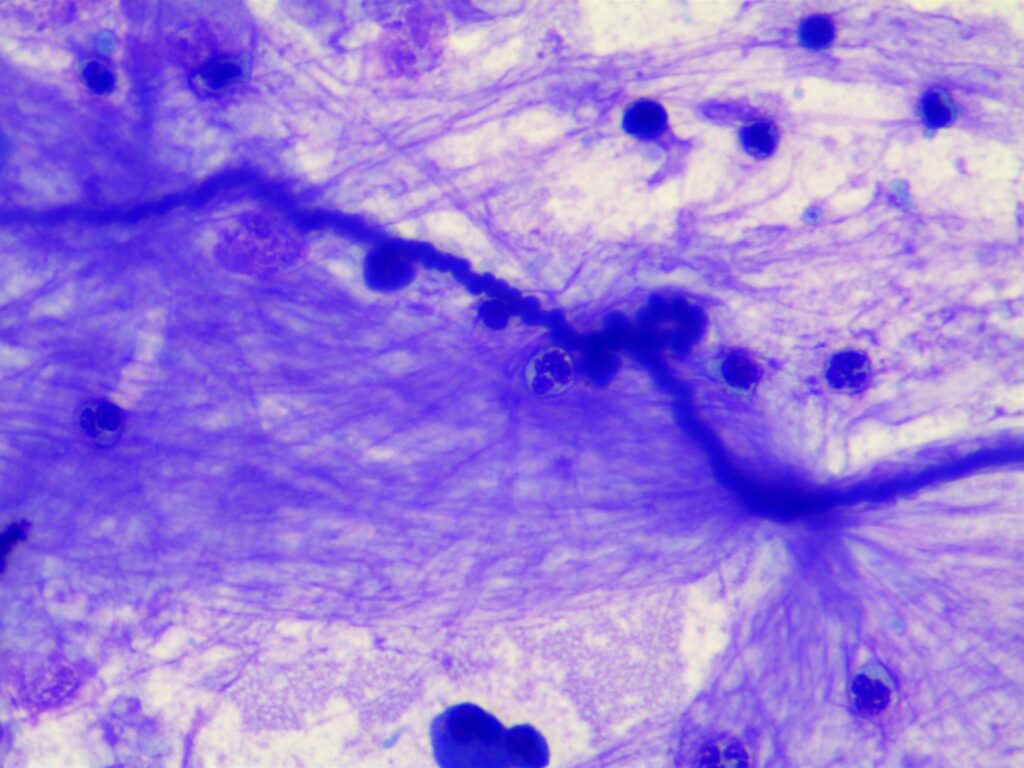
Fig. 6: Curschmann spiral, Rapid romanowsky-type stain
Source: Laboklin
Non ci sono quasi valori di riferimento per la composizione cellulare di TBS in letteratura. L’affermazione spesso citata secondo cui una percentuale superiore al 20 % di neutrofili è indicativa di un processo infiammatorio deve essere considerata con cautela. Diversi studi hanno dimostrato che anche i cavalli clinicamente sani possono avere una percentuale significativamente maggiore di neutrofili nella TBS in determinate condizioni. Le cause discusse includono l’alimentazione del fieno sotto forma di balle rotonde, l’essere all’aperto quando fa freddo e l’allenamento intensivo. La composizione cellulare del BAL è molto meno dipendente da fattori ambientali ed è quindi più adatta per la diagnosi di malattie diffuse, in particolare delle vie respiratorie più profonde.
Naturalmente, i risultati più significativi si ottengono esaminando contemporaneamente TBS e BAL.
Nelle malattie delle vie respiratorie, si verificano cambiamenti sia nel contenuto cellulare che nella proporzione dei diversi tipi cellulari. Inoltre, l’esame citologico cerca strutture come elementi fungini inalati (fig. 5), particelle vegetali e pollini (fig. 5) o agenti infettivi come i batteri. Le spirali di Curschmann (fig. 6) sono spesse secrezioni di muco delle piccole vie aeree e indicano una scarsa clearance mucociliare.
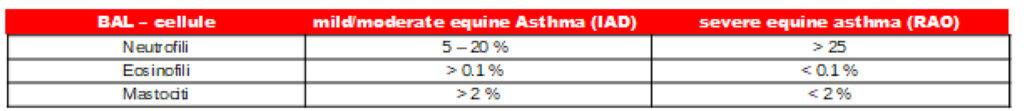
Nella differenziazione delle infiammazioni respiratorie sterili, come l’asma equina da lieve a moderato (ex IAD) e l’asma equina di alto grado (ex: ostruzione delle vie aeree ricorrenti (RAO)), è utile la determinazione del pattern cellulare del BAL (Tab. 2).
Entrambe le forme di asma determinano un aumento della percentuale di neutrofili nel campione. Nell’asma equina da lieve a moderato, l’aumento è lieve (5–20 % di neutrofili) e si può riscontrare anche un aumento dei mastociti (> 2%) e degli eosinofili (> 0,1%). L’asma equina di alto grado è associato a un marcato aumento dei neutrofili (> 25%); quasi esclusivamente, in molti casi si trovano neutrofili. L’infiammazione settica di solito provoca un numero di cellule molto elevato con percentuale molto alta di granulociti neutrofili. Senza rilevare i batteri fagocitati, l’immagine cellulare può apparire esattamente come un’infiammazione sterile di alto grado.
Pertanto, è essenziale interpretare sempre i risultati citologici in combinazione con la storia clinica e i campioni prelevati.
Se si sospetta clinicamente una malattia batterica, deve sempre essere eseguito un esame batteriologico dal TBS.
I macrofagi che presentano eritrociti fagocitati (Fig. 4) o contengono i loro prodotti di degradazione (emosiderina o ematoidina) indicano la presenza di sanguinamento nei polmoni. Lievi emorragie possono verificarsi in varie malattie e possono essere causate, ad esempio, da gravi attacchi di tosse. Tuttavia, inclusioni di sangue importanti possono indicare la presenza di emorragia polmonare indotta da esercizio (EIPH).
Naturalmente, un’emorragia deve essere distinta da un coagulo di sangue correlato al prelievo. Ciò viene assicurato valutando le preparazioni realizzate dal campione appena ottenuto. Se anche qui c’è presenza di degradazione degli eritrociti, c’è un’emorragia.
In alcune malattie polmonari rare, come la fibrosi polmonare multinodulare equina (EMPF), per la diagnosi è necessario un esame patoistologico del tessuto polmonare poiché i risultati citologici del BAL non sono specifici. Tuttavia, la PCR può analizzare il BAL per EHV-5, che è associato a EMPF.
La citologia di TBS e BAL fornisce un prezioso contributo alla diagnosi delle malattie respiratorie e fornisce informazioni sulla gravità del malattie e sugli approcci terapeutici. La selezione del materiale appropriato e l’invio di preparazioni citologiche ben valutabili sono fondamentali per risultati significativi.
Dott.ssa Maria Christian