L’esame gold standard nella diagnosi dei mastocitomi (MCT) è la citologia o l’istopatologia. La stadiazione clinica si basa sul quadro clinico compreso lo stato dei linfonodi (citologia/istologia). Sono disponibili anche metodiche immunoistologiche e genetiche per una loro caratterizzazione più precisa.
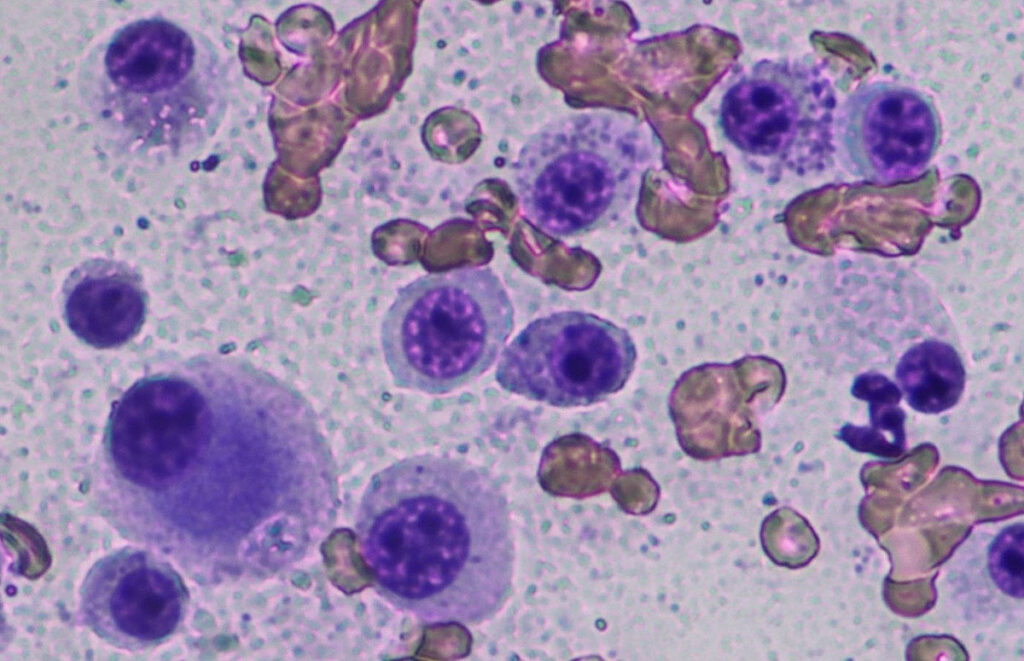
La citologia viene utilizzata per la diagnosi preoperatoria (Fig. 1) e la stadiazione clinica (ad es. linfonodi, milza). La classificazione citologica dei mastociti canini è stata pubblicata (Blackwood et al. 2012), ma presenta limitazioni perché i criteri di malignità citologica sono spesso sovrastimati e l’MCT sottocutaneo non può essere identificato.
La diagnosi istopatologica può distinguere i mastocitomi cutanei da quelli sottocutanei e può valutare i margini di resezione. Il grading istologico consente di formulare valutazioni sul comportamento biologico (probabilità di recidiva, rischio di metastasi, tempi di sopravvivenza) dei mastocitomi cutanei nel cane.
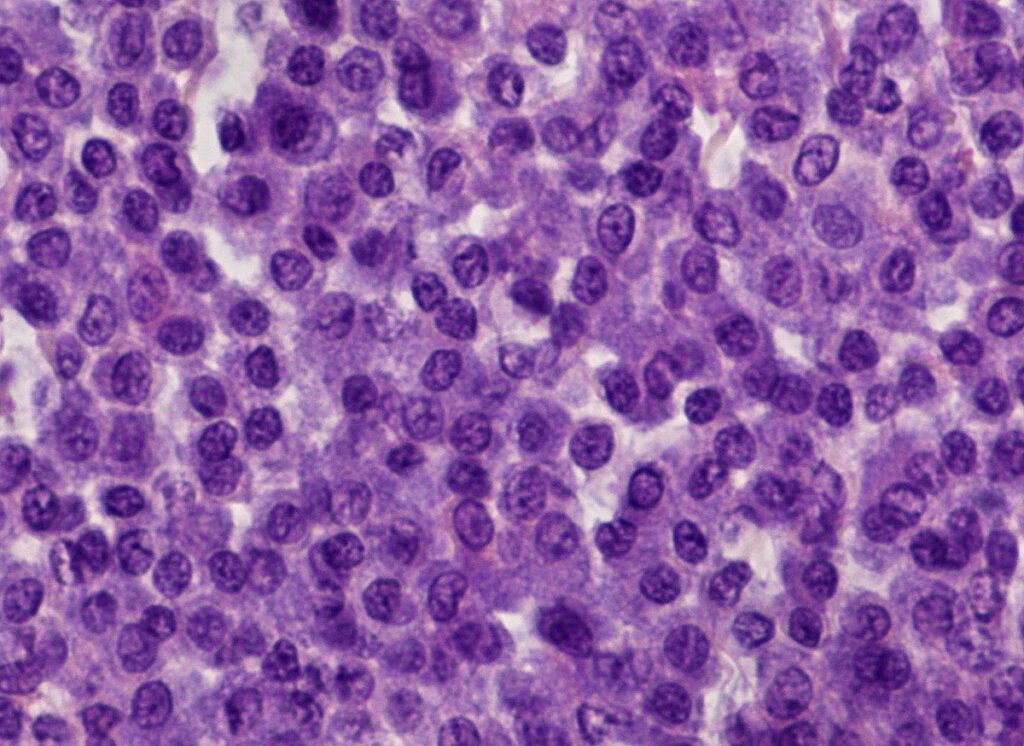
Esistono due sistemi di classificazione istopatologica per i mastociti cutanei nei cani: il vecchio sistema di classificazione secondo Patnaik et al. (1984) distingue tre gradi tumorali (grado I ben differenziato – Fig. 2 -, grado II moderatamente differenziato e grado III scarsamente differenziato). Si basa, tra l’altro, sui criteri: localizzazione del tumore, morfologia cellulare, morfologia nucleare, architettura complessiva e numero di mitosi. Poiché questo sistema comprende diversi criteri non facili da oggettivare, è stato istituito un sistema modificato a due livelli, basato su parametri più misurabili (Kiupel et al. 2011). In conformità con le raccomandazioni del Consensus Group (Berlato et al. 2021), attualmente viene solitamente fornita una combinazione di entrambi i sistemi di classificazione, che è correlata alle dichiarazioni prognostiche (Tab. 1) (Stefanello et al. 2015).
Se un mastocitoma è sottocutaneo, allora i sistemi di classificazione secondo Patnaik et al. (1984) e Kiupel et al. (2011) non possono essere utilizzati perché l’MCT sottocutaneo è generalmente meno maligno dell’MCT cutaneo (Bellamy e Berlato 2022). Con poche eccezioni, possono vemire controllati bene localmente e di solito non richiedono alcuna ulteriore terapia se sono stati completamente rimossi (Betz 2021).
Tab. 1 – Dichiarazione prognostica per i mastociti cutanei nei cani, basata sui sistemi di classificazione combinati di Patnaik et al. (1984) e Kiupel et al. (2011) – modificata da Stefanello et al. (2015)
| Classificazione | Prognosi | Morti correlate al tumore | Rischio di metastasi linfonodali | Rischio di metastasi a distanza |
| Grado I / low-grade | buono | rare | 6 % | 2 % |
| Grado II / low-grade | per lo più buona | dal 3% al 17% dei cani muore a causa dei mastocitomi | 16 % | 2 % |
| Grado II / high- grade | con riserva | dal 14% al 56% dei cani muore a causa dei mastocitomi. Tempo di sopravvivenza medio: da 7,5 a 23,3 mesi |
15 % | 2 % |
| Grado III / high- grade | con riserva fino a infausta | dal 67 al 75 % dei cani muore a causa dei mastocitomi. Tempo di sopravvivenza medio: da 3,6 a 6,8 mesi |
46 % | 21 % |
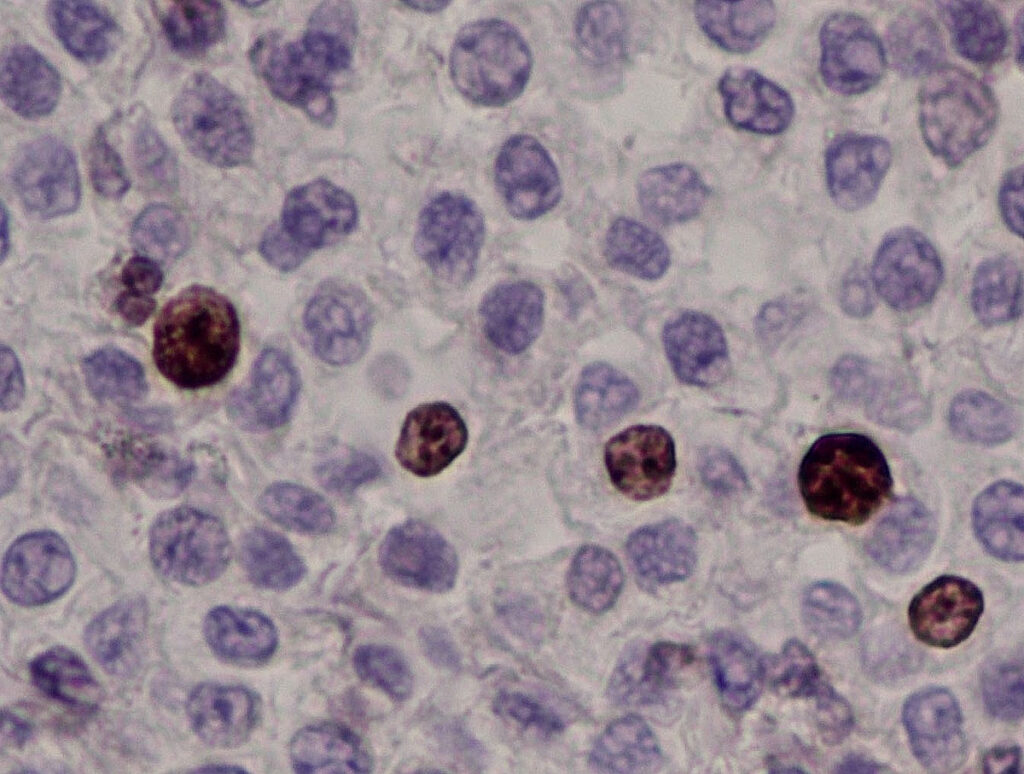
Inoltre, i linfonodi possono essere esaminati istologicamente per la ricerca di una popolazione di cellule tumorali neoplastiche. La valutazione viene effettuata utilizzando lo schema di Weishaar et al (2014). La prognosi è significativamente migliore negli stadi HN0/HN1 rispetto a quelli HN2/HN3.
HN0: da assenti a sparsi (0-3 mastociti/HPF), sparsi e solitari nel seno (sottocapsulare, paracorticale o midollare) e/o nel parenchima. Valutazione: nessuna infiltrazione metastatica (piuttosto reattiva).
HN1: più di 3 mastociti sparsi e solitari nel seno (sottocapsulare, paracorticale o midollare) e/o nel parenchima in almeno 4 HPF. Valutazione: premetastatica (zona grigia).
-
Fig. 1: Citologia: mastocitoma scarsamente differenziato
Immagine: Laboklin
-
Fig. 2: Istopatologia: mastocitoma cutaneo di grado I secondo Patnaik et al. 1984, basso grado secondo Kiupel et al. 2011
Immagine: Laboklin
-
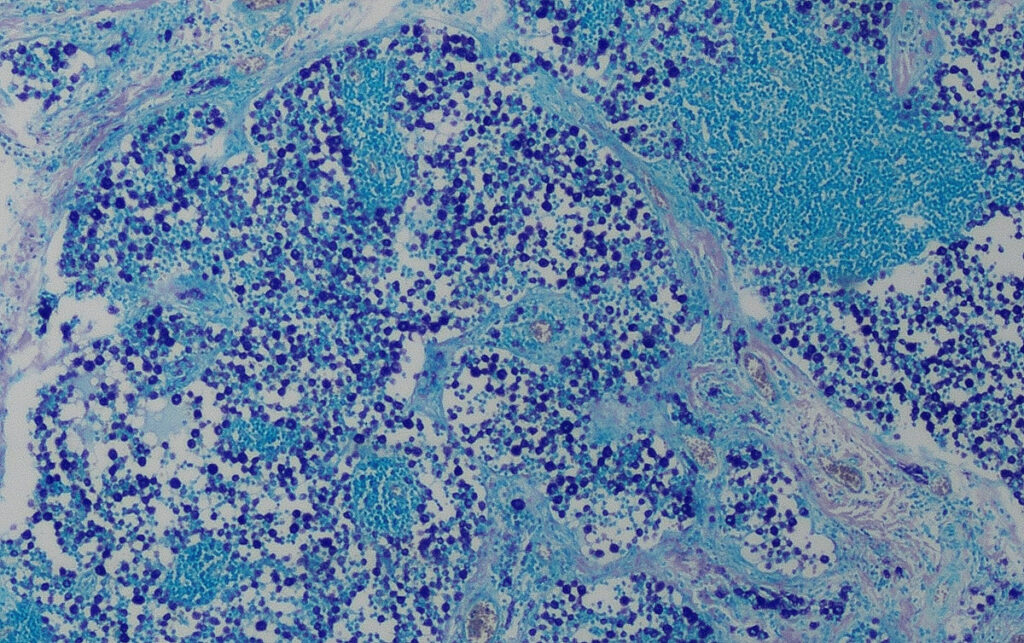
Fig. 3: Istologia (colorazione Giemsa): elevata infiltrazione dei linfonodi con mastociti, stadio HN3
Immagine: Laboklin
-
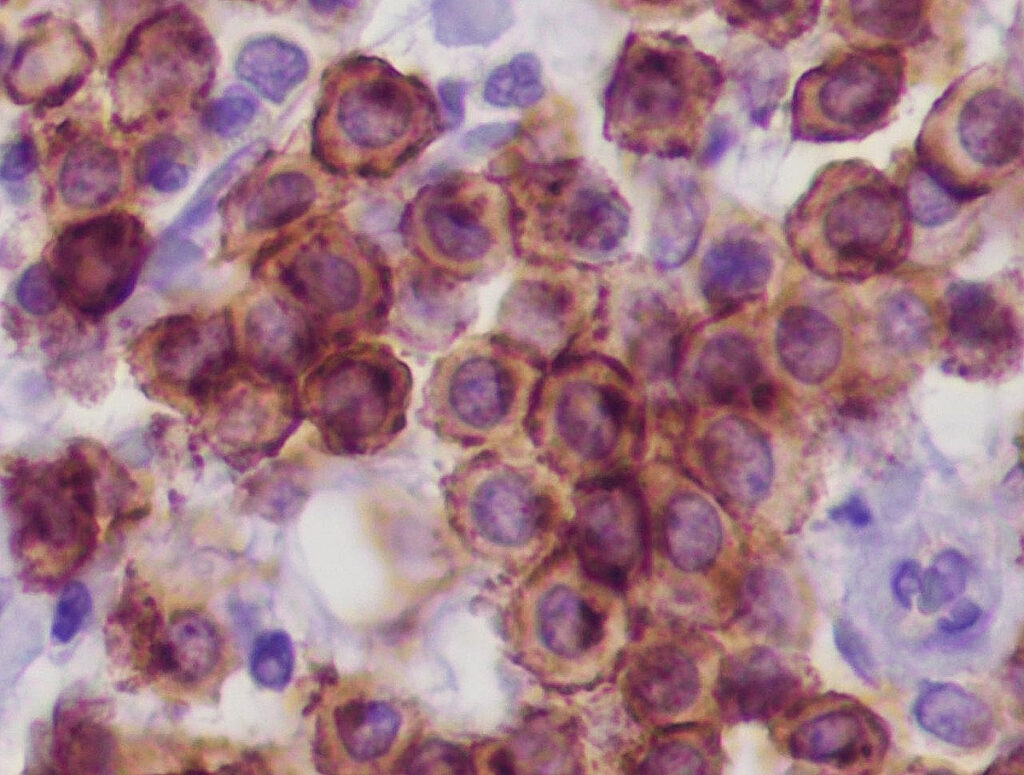
Fig. 4a: cKIT, immunoistologia: pattern di espressione membranosa regolare dei mastociti
Immagine: Laboklin
-
Fig. 4b: Antigene Ki-67, immunohistologia: i nuclei dei singoli mastociti reagiscono positivamente (marrone).
Immagine: Laboklin
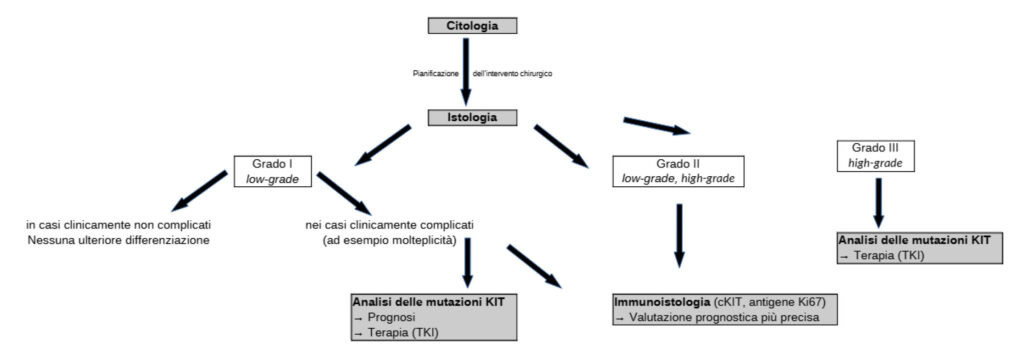
- Fig. 5 Algoritmo diagnostico per i mastociti cutanei del cane
HN2: aggregati (cluster) di mastociti (>3 cellule associate) nel seno (sottocapsulare, paracorticale o midollare) e/o accumuli parenchimali o sinusoidali di mastociti.
Valutazione: stadio iniziale delle metastasi.
HN3: distruzione della normale architettura linfonodale da parte di focolai distinti, noduli o masse più grandi di mastociti (Fig. 3).
Valutazione: metastasi manifeste.
Inoltre, sono possibili anche esami immunoistologici per i mastociti canini. Il modello di distribuzione (membranoso, perinucleare o diffuso) del recettore tirosina chinasi KIT (cKIT, Fig. 4a) (Freytag et al. 2021; Da Gil Costa et al. 2011) e il numero delle cellule tumorali che esprimono l’antigene Ki-67 (Fig. 4b) danno informazioni sul grado di differenziazione o sull’attività di proliferazione del MCT.
I risultati immunoistologici hanno solo rilevanza prognostica (non terapeutica).
Il rilevamento di un pattern di espressione cKIT atipico (tipo 2 o 3) è correlato ad una prognosi peggiore (Freytag et al. 2021). Più di 23 cellule positive al Ki-67/1 area della griglia oculare, sono associate a un tempo di sopravvivenza più breve (Webster et al. 2007).
Tuttavia, non esistono informazioni attendibili per alcune combinazioni di risultati (ad es. pattern cKIT di tipo 1 e allo stesso tempo un numero elevato di cellule tumorali positive all’antigene Ki-67). Non esiste alcuna connessione tra il pattern di espressione immunoistologica di cKIT e la presenza di una mutazione del gene KIT o la risposta alla terapia con inibitori della tirosina chinasi!
Una mutazione del gene KIT, che porta all’iperattività del recettore della tirosina chinasi KIT e alla proliferazione dei mastociti ligando-indipendente, può essere rilevata utilizzando metodi di genetica molecolare. Sulla base di questa patogenesi, gli inibitori della tirosina chinasi come toceranib fosfato e masitinib vengono utilizzati nei mastociti canini non resecabili.
La risposta dell’inibitore della tirosina chinasi masitinib è significativamente migliore in presenza di una mutazione KIT nell’esone 11 rispetto al wild type. Tuttavia, ciò non significa che in assenza di mutazione non vi sia alcun effetto terapeutico degli inibitori della tirosina chinasi (Hahn et al. 2008).
Il rilevamento di una mutazione KIT nell’esone 11 nei mastociti cutanei è significativamente correlato con un tempo di sopravvivenza più breve. I tumori dei mastociti con una mutazione nell’esone 8 sono probabilmente meno aggressivi. L’individuazione della mutazione KIT serve quindi a migliorare la valutazione della prognosi e la pianificazione della terapia individualizzata (Nardi et al. 2022; Bellamy e Berlato 2022; Thamm et al. 2019).
Tuttavia, a causa degli enzimi presenti nei granuli dei mastociti, della fissazione e dell’inclusione in paraffina (sia negli strisci che nei campioni istologici), non è sempre possibile isolare DNA di qualità sufficiente per il sequenziamento.
I mastociti sottocutanei con una mutazione KIT nell’esone 11 hanno maggiori probabilità di essere istologicamente di alto grado e di avere una conta mitotica più elevata (Chen et al.2022).
Conclusioni
In sintesi, va sottolineato ancora una volta che il grading istologico, i risultati immunoistologici e lo stato di mutazione c-Kit di un mastocitoma cutaneo, sono solo fattori prognostici individuali tra i tanti correlati al decorso clinico della malattia. A seconda della singola situazione ha senso effettuare ulteriori indagini diverse (fig. 5). Tuttavia, nella valutazione finale di ogni singolo caso, devono essere considerati numerosi altri parametri clinici nonché la localizzazione anatomica del mastocitoma (Willmann et al. 2021; Blackwood et al. 2012).
PD Dott.ssa Heike Aupperle-Lellbach
Esami a disposizione
- Citologia
- Istopatologia
- Istopatologia con approfondimenti
- Mutazione c-Kit
- Esame immunoistologico